1
Steinke W,et al.:Arzneim-Forsch/Drug Res.1997;47:939-948.
2
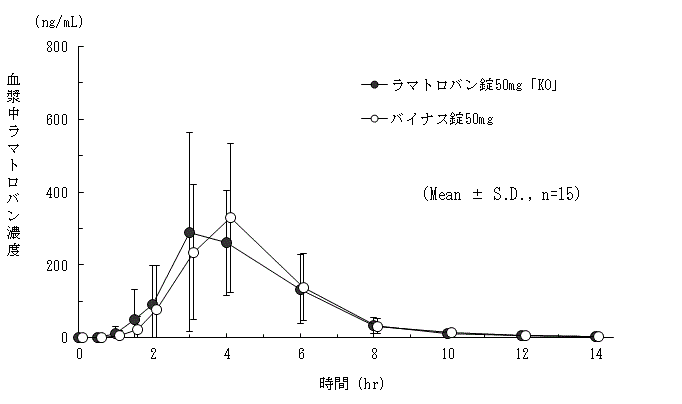
25mg錠と75mg錠の同等性の検証(バイナス錠:2000年3月10日承認、申請資料概要へ-4.(2))
3
安永幸二郎他:臨床医薬.1996;12:2523-2539.
4
東純一他:臨床医薬.1997;13:511-524.
5
東純一他:臨床医薬.1997;13:525-535.
6
蓮沼智子他:新薬と臨牀.2018;67:1466-1479.
7
沖守他:新薬と臨牀.2018;67:1480-1492.
8
ヒト代謝物の検討(バイナス錠:2000年3月10日承認、申請資料概要へ-3.(1))
9
谷河賞彦他:薬物動態.1997;12:121-129.
10
薬物相互作用の検討(バイナス錠:2000年3月10日承認、申請資料概要へ-3.(5))
11
血漿蛋白との結合性(バイナス錠:2000年3月10日承認、申請資料概要へ-2.(2).4))
12
馬場駿吉他:耳鼻臨床.1996;補87:1-32.
13
ラマトロバンの抗アレルギー性鼻炎作用(バイナス錠:2000年3月10日承認、申請資料概要ホ-1.(1))
14
Theis JGW,et al.:Biochem Pharmacol.1992;44:495-503.
15
Perzborn E,et al.:Arzneim-Forsch/Drug Res.1989;39:1522-1525.
16
Sugimoto H,et al.:J Pharmacol Exp Ther.2003;305:347-352.
17
Shichijo M,et al.:J Pharmacol Exp Ther.2003;307:518-525.
18
Yoshimura-Uchiyama C,et al.:Clin Exp Allergy.2004;34:1283-1290.
19
広中隆他:薬理と治療.1996;24:159-165.
20
Narita S:Int Arch Allergy Immunol.1996;109:161-166.