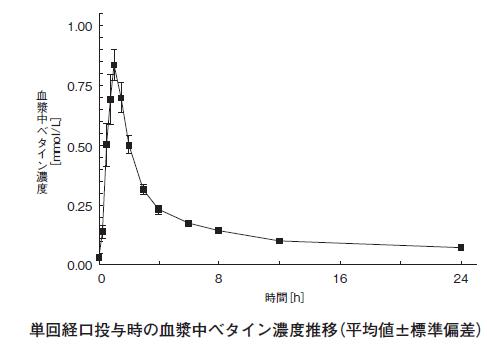
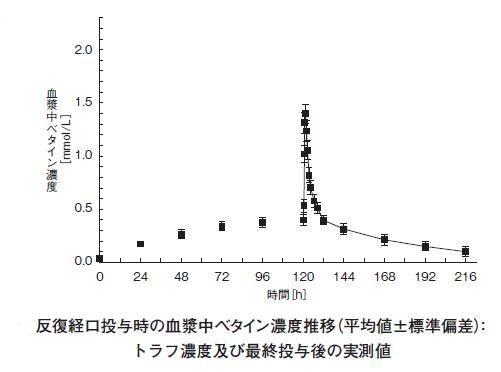
1
Matthews A, et al. Br J Clin Pharmacol. 2002; 54: 140-146
2
社内資料:ホモシスチン尿症患者を対象としたRM-003の第III相臨床試験-継続投与期32週目評価時-
3
Schwahn BC, et al. Br J Clin Pharmacol. 2003; 55: 6-13
4
Nielsen CU, et al. Eur J Pharm Biopharm. 2012; 81: 458-462
5
Maclean KN, et al. Mol Genet Metab. 2010; 101: 153-162
6
Van der Westhuyzen J, et al. Br J Nutr. 1985; 53: 657-662
7
Schwahn BC, et al. Atherosclerosis. 2007; 195: e100-e107
8
Schwahn BC, et al. Biochem J. 2004; 382: 831-840