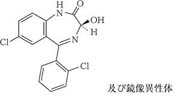
1
江崎孝三郎他:実中研・前臨床, 1975;1:25-34
2
Jurand, A. et al.:Pharmacology & Toxicology, 1994;74:228-235
3
Pasbakhsh, P. et al.:Acta Medica Iranica, 2003;41:29-32
4
Summerfield, R. J. et al.:Br. J. Anaesth., 1985;57(10):1042-1043
5
林長蔵他:臨床化学, 1975;4(1):99-106
6
Greenblatt, D. J. et al.:Clin. Pharmacol. Ther., 1976;20(3):329-341
7
Chin, P. K. L. et al.:Br. J. Clin. Pharmacol., 2011;72(6):985-989
8
代謝(ロラピタ静注:2018年9月21日承認、申請資料概要2.7.2.3)
9
Herman, R. J. et al.:Clin. Pharmacol. Ther., 1989;46(1):18-25
10
第十八改正日本薬局方解説書, 廣川書店, 2021;C-1825
11
安東潔他:日本薬理学雑誌, 1974;70(5):637-647
12
五味田裕他:医学研究, 1974;44(6):602-618