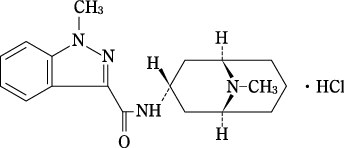
1
Baldwin, J. A. et al.:基礎と臨床,1990;24:5043-5053
2
Baldwin, J. A. et al.:基礎と臨床,1990;24:5055-5069
3
Haddock, R. E. et al.:基礎と臨床,1990;24:6821-6843
4
熊倉博之他:臨床医薬,1990;6(Suppl.5):25-34
5
小柳純子他:臨床医薬,1990;6(Suppl.5):3-24
6
小柳純子他:臨床医薬,1990;6(Suppl.5):35-47
7
欧米人小児癌患者及び成人癌患者における薬物動態(カイトリル注射液:2000年7月3日承認、申請資料概要ヘ.2. 2-1)
8
Bloomer, J. C. et al.:Br. J. Clin. Pharmacol., 1994;38(6):557-566
9
Clarke, S. E. et al.:Xenobiotica, 1994;24(11):1119-1131
10
古江尚他:臨床医薬,1990;6(Suppl.5):63-86
11
仁井谷久暢他:臨床医薬,1990;6(Suppl.5):87-105
12
町田豊平他:臨床医薬,1990;6(Suppl.5):107-120
13
小児領域における抗悪性腫瘍剤投与に伴う悪心・嘔吐に対する臨床試験(カイトリル注射液:2000年7月3日承認、申請資料概要ト.1)
14
岡本真一郎他:今日の移植,1999;12:437-444
15
Blower, P. R.:Eur. J. Cancer, 1990;26(Suppl.1):8-11
16
Sanger, G. J. et al.:Eur. J. Pharmacol., 1989;159:113-124
17
Bermudez, J. et al.:Br. J. Cancer, 1988;58:644-650
18
シスプラチン誘発嘔吐に対する作用(カイトリル注射液:2000年7月3日承認、申請資料概要ホ.1. 1-1)
19
全身X線照射誘発嘔吐に対する作用(カイトリル注射液:2000年7月3日承認、申請資料概要ホ.1. 1-1)