1
社内資料:反復投与毒性試験等(2019年9月20日承認、CTD2.6.6.3、2.6.6.5)[EQF-0016]
2
社内資料:生殖発生毒性試験(2019年9月20日承認、CTD 2.6.6.6)[EQF-0017]
3
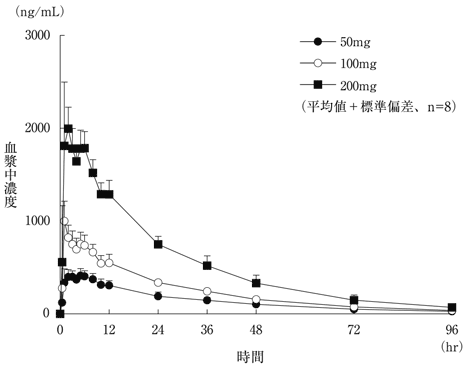
社内資料:健康成人における薬物動態試験(2019年9月20日承認、CTD2.7.6.6)[EQF-0018]
4
社内資料:生物学的利用率試験(2019年9月20日承認、CTD2.7.6.2)[EQF-0019]
5
社内資料:食事の影響試験(2019年9月20日承認、CTD2.7.6.1)[EQF-0020]
6
社内資料:In vitro血漿蛋白結合率試験(2019年9月20日承認、CTD2.6.4.4.8)[EQF-0021]
7
社内資料:In vitro代謝試験(2019年9月20日承認、CTD2.6.4.5)[EQF-0022]
8
社内資料:薬物相互作用試験(ケトコナゾール)(2019年9月20日承認、CTD2.7.6.14)[EQF-0023]
9
社内資料:健康成人におけるマスバランス試験(2019年9月20日承認、CTD2.7.6.10)[EQF-0024]
10
社内資料:腎機能障害者における薬物動態試験(2019年9月20日承認、CTD2.7.6.11)[EQF-0025]
11
社内資料:肝機能障害者における薬物動態試験(2019年9月20日承認、CTD2.7.6.12)[EQF-0026]
12
社内資料:薬物相互作用試験(ミダゾラム)(2019年9月20日承認、CTD2.7.6.15)[EQF-0027]
13
社内資料:薬物相互作用試験(カフェイン)(2019年9月20日承認、CTD2.7.6.15)[EQF-0028]
14
社内資料:薬物相互作用試験(ロスバスタチン)(2019年9月20日承認、CTD2.7.6.19)[EQF-0029]
15
社内資料:薬物相互作用試験(レボドパ/カルビドパ)(2019年9月20日承認、CTD2.7.6.16)[EQF-0030]
16
社内資料:In vitro酵素誘導試験(2019年9月20日承認、CTD2.6.4.7)[EQF-0031]
17
社内資料:国内第Ⅱ/Ⅲ相試験(2019年9月20日承認、CTD2.7.6.25)[EQF-0032]
18
社内資料:国内長期投与試験(2019年9月20日承認、CTD 2.7.6.35)[EQF-0033]
19
社内資料:QT/QTc評価試験(2019年9月20日承認、CTD 2.7.6.20)[EQF-0034]
20
社内資料:薬効薬理試験(2019年9月20日承認、CTD2.6.2.2)[EQF-0035]