1
古家英寿 他:臨床薬理、2013;44(2):53-60
2
上野文昭 他:新薬と臨牀、2016;65(5):681-695
3
松田砂織 他:新薬と臨牀、2012;61(12):2507-2513
経口腸管洗浄剤
1袋 1730.1円
| 大室 (A剤) | 成分 1袋(244.212g)中 | 塩化ナトリウム 5.382g | 塩化カリウム 2.03g | 無水硫酸ナトリウム 15.0g | マクロゴール4000 200.0g |
|---|---|---|---|---|---|
| 小室 (B剤) | 成分 1袋(244.212g)中 | アスコルビン酸 9.4g | L-アスコルビン酸ナトリウム 11.8g | ||
| 添加剤 | アセスルファムカリウム、サッカリンナトリウム水和物、香料 |
| 性状 | 大室(A剤) 白色の粉末 小室(B剤) 白色~黄白色の粉末 A剤及びB剤を混合・溶解後の水溶液 無色澄明 pHは約4.3 浸透圧比は約1.9 |
|---|
0.1~5%未満 | 頻度不明 | |
|---|---|---|
過敏症 | 発疹 | そう痒症、じん麻疹、血管浮腫 |
精神神経系 | 頭痛 | 睡眠障害、痙攣、浮動性めまい |
消化器 | 悪心、嘔吐、腹痛 | 腹部膨満、肛門不快感、消化不良、嚥下障害、鼓腸 |
循環器 | 血圧低下、徐脈 | 血圧上昇 |
肝臓 | AST増加、ALT増加、血中LDH増加、肝機能異常 | |
腎臓 | 尿中蛋白陽性 | |
血液 | 白血球数増加、好中球百分率増加、リンパ球百分率減少 | |
その他 | 口渇、血中コレステロール増加、血中CK増加 | 倦怠感、悪寒、空腹、不快感、血中重炭酸塩減少、高カルシウム血症、低カルシウム血症、低リン酸血症、低カリウム血症、血中クロール異常、脱水 |
(1) 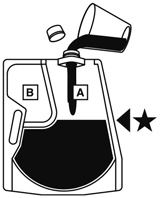 | (2) 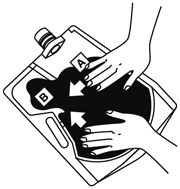 |
上部のキャップを開けて★の目印まで水を入れる。 | キャップをきちんと閉め、バッグを寝かせて、大室(A剤)の上から両手で押して大室と小室(B剤)との隔壁を開通させる。 |
(3) 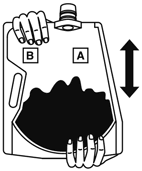 | (4) 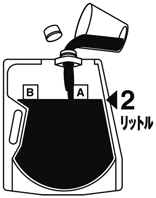 |
バッグを良く振り本剤を溶解する。 | キャップを開けて2Lの目盛り線までさらに水を入れる。 |
(5) 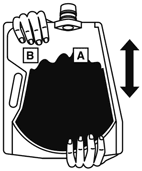 | |
キャップをしっかりと閉めて軽く振り、本剤が完全に溶解したことを確認する。 |
本剤群 | ニフレックⓇ配合内用剤群 | |
有効率(例数) | 98.6%(215/218例) | 96.8%(212/219例) |
 0120-917-719
0120-917-719