1
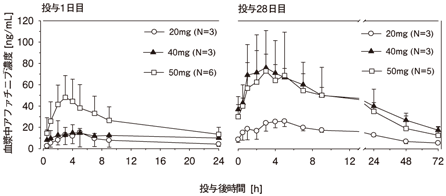
社内資料:国内第Ⅰ/Ⅱ相試験(LUX-Lung 4)薬物動態の検討(第Ⅰ相)(2014年1月17日承認、CTD 2.7.2.2)
2
社内資料:海外第Ⅰ相試験 食事の影響(2014年1月17日承認、CTD 2.7.1.3)
3
社内資料:非臨床薬物動態試験(血漿蛋白結合及び血球移行)(2014年1月17日承認、CTD 2.6.4.4)
4
社内資料:非臨床薬物動態試験(血漿蛋白結合)(2014年1月17日承認、CTD 2.6.4.4)
5
社内資料:in vitroにおける代謝の検討(2014年1月17日承認、CTD 2.6.4.5)
6
社内資料:臨床薬物動態試験(2014年1月17日承認、CTD 2.7.2.2)
7
社内資料:非臨床薬物動態試験(トランスポーター)(2014年1月17日承認、CTD 2.6.4.5)
8
社内資料:非臨床薬物動態試験(トランスポーター)(2014年1月17日承認、CTD 2.6.4.5)
9
社内資料:非臨床薬物動態試験(トランスポーター)(2014年1月17日承認、CTD 2.6.4.5)
10
社内資料:母集団薬物動態解析(2014年1月17日承認、CTD 2.7.2.2)
11
社内資料:母集団薬物動態解析(2014年1月17日承認、CTD 2.7.2.2)
12
社内資料:肝機能障害者における薬物動態の検討(2014年1月17日承認、CTD 2.7.2.2)
13
社内資料:リトナビルとの相互作用(2014年1月17日承認、CTD 2.7.2.3)
14
社内資料:リトナビルとの相互作用(2014年1月17日承認、CTD 2.7.2.3)
15
社内資料:リファンピシンとの相互作用(2014年1月17日承認、CTD 2.7.2.3)
16
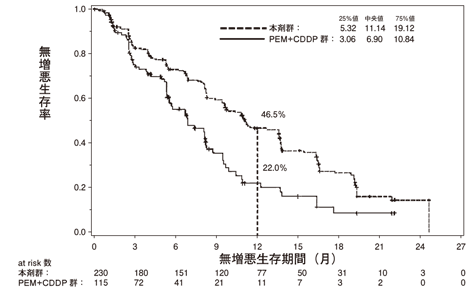
社内資料:国際共同第Ⅲ相試験(LUX-Lung 3)(2014年1月17日承認、CTD 2.7.3.2、2.7.3.3)
17
社内資料:薬効薬理の検討(受容体結合実験)(2014年1月17日承認、CTD 2.6.2.2)
18
社内資料:薬効薬理の検討(EGFR、HER2キナーゼ等に対する作用)(2014年1月17日承認、CTD 2.6.2.2)
19
社内資料:薬効薬理の検討(種々の蛋白質キナーゼに関する選択性)(2014年1月17日承認、CTD 2.6.2.2)
20
社内資料:薬効薬理の検討(HER4キナーゼアッセイ)(2014年1月17日承認、CTD 2.6.2.2)
21
社内資料:薬効薬理の検討(EGFR変異株に対する阻害作用)(2014年1月17日承認、CTD 2.6.2.2)
22
Li D. et al.:Oncogene. 2008;27(34):4702-4711



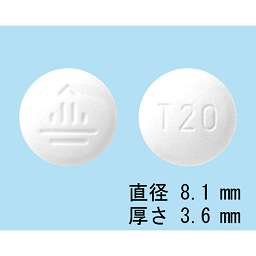

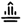 T20
T20
 T30
T30
 T40
T40