1
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書 レボホリナートカルシウム(小腸癌)
2
医療上の必要性の高い未承認薬・適応外薬検討会議 公知申請への該当性に係る報告書 レボホリナートカルシウム(治癒切除不能な進行・再発の胃癌)
3
川田和仁 他:薬理と治療. 1994;22(9):3889-3904
4
第十八改正日本薬局方解説書 廣川書店 2021;C6276-C6284
5
佐々木常雄 他:癌と化学療法. 1993;20(4):485-491
6
佐々木常雄 他:癌と化学療法. 1995;22(4):521-529
7
竹田彬一 他:癌と化学療法. 1995;22(7):903-910
8
赤沢修吾 他:日本癌治療学会誌. 1995;30(3):569-583
9
菅野康吉 他:癌と化学療法. 1995;22(5):627-637
10
吉野正曠 他:癌と化学療法. 1995;22(6):785-792
11
小西孝司 他:癌と化学療法. 1995;22(7):925-932
12
Conroy T., et al.:N. Engl. J. Med. 2011;364(19):1817-1825
13
膵癌FOLFIRINOX法に関する海外臨床試験(アイソボリン点滴静注用:2013年12月20日承認、審査報告書)
14
Okusaka T., et al.:Cancer Sci. 2014;105(10):1321-1326
15
相羽恵介 他:BIOCHEMICAL MODULATIONの基礎と臨床(金丸龍之介、小西敏郎 編集). 第1版. 医学書院. 1995;29-39
16
Sugimoto Y., et al.:Cancer Chemother. Pharmacol. 1992;30:417-422
17
Kase S., et al.:Surg. Today. 1993;23(7):615-620
18
加瀬卓 他:日本外科学会雑誌. 1993;94(6):659



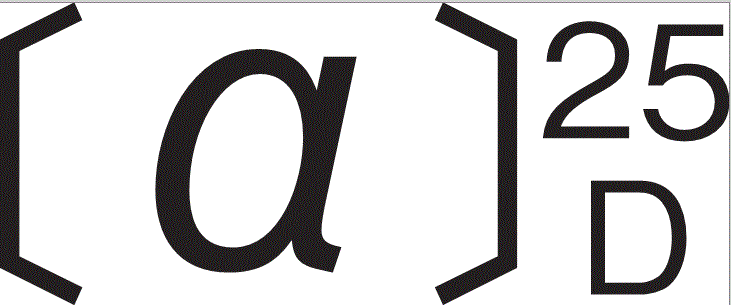 :-10~-15゜
:-10~-15゜

