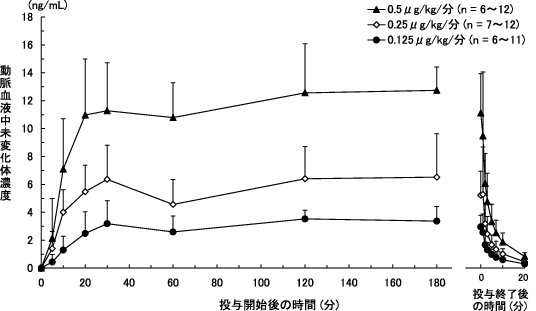
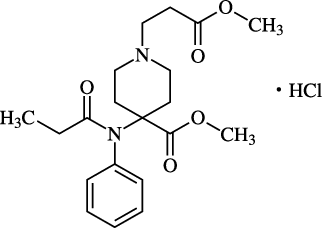
1
Abernethy DR, et al.:Clin Pharmacokinet. 1982;7(2):108-124
2
Minto CF, et al.:Anesthesiology 1997;86(1):10-23
3
Lang E, et al.:Anesthesiology 1996;85(4):721-728
4
Reid JE, et al.:Br J Anaesth. 2000;84(3):422-423
5
Russell D, et al.:Br J Anaesth. 1997;79(4):456-459
6
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(2)1)①)
7
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(2)2)①)
8
槇田浩史, 他:麻酔と蘇生, 2005;41(4):105-115
9
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2016年8月26日承認 申請資料概要 2.7.2.2.1.1)
10
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 2(2)3))
11
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ホ 1(4))
12
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 2(3)4))
13
Davis, P. J., et al.:Anesth. Analg., 2002;95(5):1305-1307
14
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(6)1))
15
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(3)3))
16
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(3)1))
17
Hoke, J. F., et al.:Anesthesiology, 1997;87(3):533-541
18
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(3)2))
19
Dershwitz, M., et al.:Anesthesiology, 1996;84(4):812-820
20
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ヘ 3(3)4))
21
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ト 3)
22
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ト 4)
23
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ト 5)
24
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2016年8月26日承認 申請資料概要 2.7.6.3)
25
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ホ 1(3)2)②)
26
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ホ 1(1)1))
27
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ホ 1(4)1))
28
Hoke, J. F., et al.:J Pharmacol Exp Ther. 1997;281(1):226-32
29
申請資料概要(アルチバ静注用2mg/アルチバ静注用5mg 2006年10月20日承認 申請資料概要 ホ(3)1))
30
申請資料概要(2022年8月24日承認、2.7.2.2)
31
申請資料概要(2022年8月24日承認、2.7.6.1)