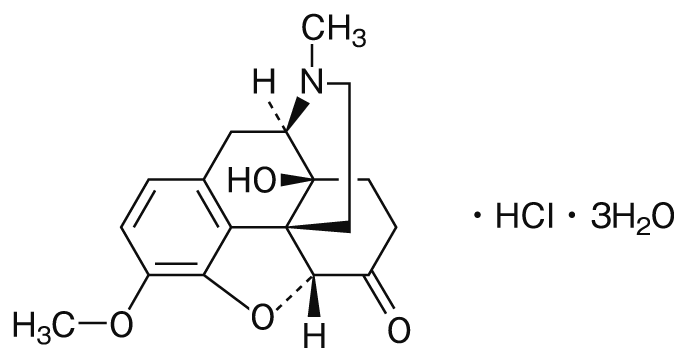
持続性癌疼痛治療剤
1カプセル 92円
| 性状・剤形 | 白色の顆粒を、ボディが白色、キャップが橙色のカプセルに充てんした硬カプセル剤である。 |
|---|---|
| 外 形 |  4号カプセル |
| 大きさ(mm) | 長径:14.3 短径:5.3 |
| 質量(g) | 約0.061 |
| 識別コード | TF11 |
| 性状・剤形 | 白色の顆粒を、ボディが白色、キャップが青色のカプセルに充てんした硬カプセル剤である。 |
|---|---|
| 外 形 |  4号カプセル |
| 大きさ(mm) | 長径:14.3 短径:5.3 |
| 質量(g) | 約0.083 |
| 識別コード | TF12 |
| 性状・剤形 | 白色の顆粒を、ボディが白色、キャップが桃色のカプセルに充てんした硬カプセル剤である。 |
|---|---|
| 外 形 |  4号カプセル |
| 大きさ(mm) | 長径:14.3 短径:5.3 |
| 質量(g) | 約0.128 |
| 識別コード | TF13 |
| 性状・剤形 | 白色の顆粒を、ボディが白色、キャップが黄色のカプセルに充てんした硬カプセル剤である。 |
|---|---|
| 外 形 |  3号カプセル |
| 大きさ(mm) | 長径:15.8 短径:5.8 |
| 質量(g) | 約0.227 |
| 識別コード | TF14 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| **ナルメフェン塩酸塩水和物 セリンクロ | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。[【禁忌】の項参照] | μオピオイド受容体拮抗作用により、本剤の作用が競合的に阻害される。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 中枢神経抑制剤 フェノチアジン誘導体 バルビツール酸誘導体等 吸入麻酔剤 MAO阻害剤 三環系抗うつ剤 β遮断剤 アルコール | 臨床症状:呼吸抑制、低血圧及び顕著な鎮静又は昏睡が起こることがある。 措置方法:減量するなど慎重に投与すること。 | 相加的に中枢神経抑制作用を増強させる。 |
| クマリン系抗凝血剤 ワルファリン | クマリン系抗凝血剤の作用が増強されることがあるので投与量を調節するなど慎重に投与すること。 | 機序は不明 |
| 抗コリン作用を有する薬剤 | 臨床症状:麻痺性イレウスに至る重篤な便秘又は尿貯留が起こることがある。 | 相加的に抗コリン作用を増強させる。 |
| ブプレノルフィン、ペンタゾシン等 | 本剤の鎮痛作用を減弱させることがある。また、退薬症候を起こすことがある。 | ブプレノルフィン、ペンタゾシン等は本剤の作用するμ受容体の部分アゴニストである。 |
| *CYP3A4阻害作用を有する薬剤 ボリコナゾール、イトラコナゾール、フルコナゾール、リトナビル、クラリスロマイシン等 | 本剤の血中濃度が上昇し、副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | CYP3A4を介する本剤の代謝が阻害される。 |
| *CYP3A4誘導作用を有する薬剤 リファンピシン、カルバマゼピン、フェニトイン等 | 本剤の血中濃度が低下し、作用が減弱する可能性がある。なお、これらの薬剤の中止後に、本剤の血中濃度が上昇し、副作用が発現するおそれがあるので、観察を十分に行い、慎重に投与すること。 | CYP3A4を介する本剤の代謝が促進される。 |

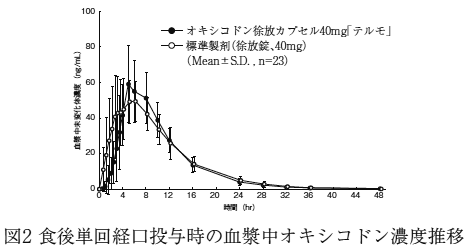
| n | AUC0-48 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | ||
| オキシコドン 徐放カプセル 40mg「テルモ」 | オキシコドン | 24 | 552.3±103.3 | 54.7±10.6 | 2.7±1.6 | 6.1±1.5 |
| オキシコドン 徐放カプセル 40mg「テルモ」 | ノルオキシコドン | 24 | 635.8±177.1 | 48.8±12.4 | 3.9±1.3 | 6.5±0.8 |
| 標準製剤 (徐放錠、40mg) | オキシコドン | 24 | 572.6±113.3 | 53.3±12.0 | 2.5±1.2 | 5.0±1.1 |
| 標準製剤 (徐放錠、40mg) | ノルオキシコドン | 24 | 657.4±169.6 | 48.0±8.6 | 3.3±1.1 | 6.5±1.1 |
| n | AUC0-48 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | ||
| オキシコドン 徐放カプセル 40mg「テルモ」 | オキシコドン | 23 | 604.2±114.9 | 68.1±19.2 | 6.0±2.1 | 5.8±2.0 |
| オキシコドン 徐放カプセル 40mg「テルモ」 | ノルオキシコドン | 23 | 490.4±111.5 | 38.9±12.6 | 6.7±2.3 | 6.5±0.8 |
| 標準製剤 (徐放錠、40mg) | オキシコドン | 23 | 632.6±114.8 | 62.3±10.5 | 4.5±2.5 | 4.5±0.9 |
| 標準製剤 (徐放錠、40mg) | ノルオキシコドン | 23 | 516.9±139.9 | 35.1±9.2 | 5.2±2.3 | 5.9±0.9 |
| 疼痛コントロール達成例数 /評価対象例数 | 疼痛コントロールの維持率注) (%) [95%信頼区間] |
| 58/71 | 81.7%[0.71−0.90] |
| 試験法 | ED50(95%信頼区間)mg/kg オキシコドン | ED50(95%信頼区間)mg/kg モルヒネ硫酸塩 |
| TF | 0.94(0.40-2.20) | 1.92(0.89-4.14) |
| HP | 1.37(0.48-3.92) | 0.85(0.39-1.86) |
| PPQ | 0.38(0.19-0.75) | 0.40(0.20-0.80) |