禁煙補助薬
1枚 222.7円
| 外観・性状 | 粘着面が微黄色〜淡黄色であり、支持体はうすいだいだい色の円形の平板である。 |
|---|---|
| 外形 |  |
| 識別コード | CG EME |
| 大きさ(約) | 直径:62mm 質量:2.0g |
| 外観・性状 | 粘着面が微黄色〜淡黄色であり、支持体はうすいだいだい色の円形の平板である。 |
|---|---|
| 外形 | 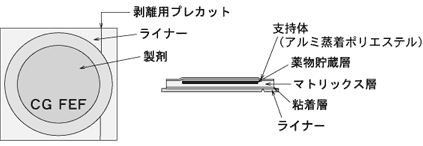 |
| 識別コード | CG FEF |
| 大きさ(約) | 直径:51mm 質量:1.3g |
| 外観・性状 | 粘着面が微黄色〜淡黄色であり、支持体はうすいだいだい色の円形の平板である。 |
|---|---|
| 外形 |  |
| 識別コード | CG CWC |
| 大きさ(約) | 直径:36mm 質量:0.7g |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| アドレナリン遮断薬 | 本剤との併用により、アドレナリン遮断性の薬剤の作用を減弱させるおそれがある。 必要に応じてアドレナリン遮断性の薬剤を増量するなど用量に注意すること。 | ニコチンにより血中コルチゾール、カテコラミンの量が増加する。 |
| アドレナリン作動薬 | 本剤との併用により、アドレナリン作動性の薬剤の作用を増強させるおそれがある。 必要に応じてアドレナリン作動性の薬剤を減量するなど用量に注意すること。 | ニコチンにより血中コルチゾール、カテコラミンの量が増加する。 |


