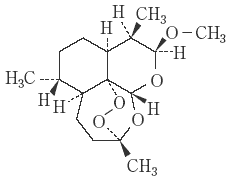
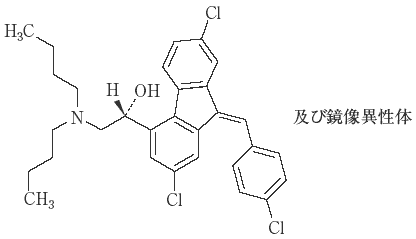
1
社内資料:日本人健康成人男性における単回投与試験(2016年12月19日承認、CTD2.7.6-2.1.1)[20160935]
2
社内資料:外国人健康成人におけるQT間隔に対する影響(2016年12月19日承認、CTD2.7.6-3.1.1)[20160936]
3
Djimdé, A. et al.:Antimicrob. Agents. Chemother. 2011;55(9):3994-3999[20160920]
4
White, N.J. et al.:Clin. Pharmacokinet. 1999;37(2):105-125[20160919]
5
Colussi, D. et al.:Eur. J. Pharma. Sci. 1999;9(1):9-16[20160921]
6
Lefèvre, G. et al.:Clin. Drug Invest. 1999;18(6):467-480,[20160922]
7
Hatz, C. et al.:Am. J. Trop. Med. Hyg. 2008;78(2):241-247[20160924]
8
Kiang, T.:Clinical Pharmacokinetic and Pharmacodynamic Drug Interactions Associated with Antimalarials 2014;13[20160923]
9
Lamorde, M. et al.:AIDS 2013;27(6):961-965[20160928]
10
Lefèvre, G. et al.:Br. J. Clin. Pharmacol. 2002;54(5):485-492[20160925]
11
Lefèvre, G. et al.:Eur. J. Pharm. Sci. 2000;10(2):141-151[20160926]
12
Lefèvre, G. et al.:J. Clin. Pharmacol. 2002;42(10):1147-1158[20160927]
13
German, P. et al.:J. Acquired Immune Defic. Syndr. 2009;51(4):424-429[20160929]
14
Huang, L. et al.:J. Acquired Immune Defic. Syndr. 2012;61(3):310-316[20160930]
15
van Agtmael, M.A. et al.:Eur. J. Clin. Pharmacol. 1999;55(5):405-410[20160931]
16
社内資料:外国人合併症のない急性熱帯熱マラリア患者を対象とした臨床試験の結果(2016年12月19日承認、CTD2.7.3-3.2.1)[20160937]
17
Meshnick, S.R. et al.:Microbiol. Rev. 1996;60(2):301-315[20160932]
18
Eastman, R.T. et al.:Nat. Rev. Microbiol. 2009;7(12):864-874[20160933]
19
Hassan Alin, M. et al.:Am. J. Trop. Med. Hyg. 1999;61(3):439-445[20160934]
20
社内資料:アルテメテル、ルメファントリン及び併用に対する耐性発現検討(2016年12月19日承認、CTD2.6.2-2.1.5)[20160938]