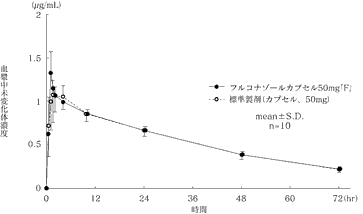
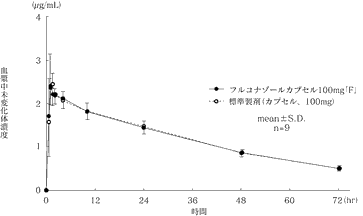
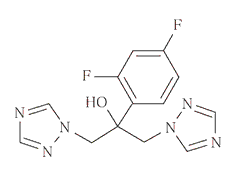
深在性真菌症治療剤
1カプセル 173.6円
| 色・剤形 | ボディ白色、キャップ白色の硬カプセル剤である。 カプセルの内容物は白色〜微黄白色の粉末である。 |
|---|---|
| 外形 | 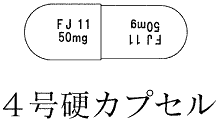 |
| 大きさ(直径) | 5.2mm |
| 大きさ(長さ) | 14.4mm |
| 識別コード | FJ11 |
| 色・剤形 | ボディだいだい色、キャップだいだい色の硬カプセル剤である。 カプセルの内容物は白色〜微黄白色の粉末である。 |
|---|---|
| 外形 | 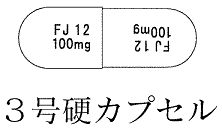 |
| 大きさ(直径) | 5.7mm |
| 大きさ(長さ) | 15.6mm |
| 識別コード | FJ12 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| トリアゾラム (ハルシオン 等) | トリアゾラムの代謝遅滞による血中濃度の上昇、作用の増強及び作用時間延長の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| エルゴタミン酒石酸塩・無水カフェイン・イソプロピルアンチピリン (クリアミン配合錠) ジヒドロエルゴタミン | アゾール系抗真菌剤等のCYP3A4を阻害する薬剤とエルゴタミンとの併用により、エルゴタミンの血中濃度が上昇し、血管れん縮等の副作用を起こすおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| **,*キニジン (キニジン硫酸塩) ピモジド | これらの薬剤の血中濃度が上昇することにより、QT延長、torsade de pointesを発現するおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| アスナプレビル (スンベプラ) ダクラタスビル・アスナプレビル・ベクラブビル (ジメンシー配合錠) | これらの薬剤の血中濃度が上昇することにより、肝胆道系の副作用が発現し、また重症化するおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3Aを阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| アゼルニジピン (カルブロック) オルメサルタン メドキソミル・アゼルニジピン (レザルタス配合錠) | イトラコナゾールとの併用によりアゼルニジピンのAUCが上昇することが報告されている。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ロミタピド (ジャクスタピッド) | ロミタピドの血中濃度が著しく上昇するおそれがある。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ブロナンセリン (ロナセン) ルラシドン (ラツーダ) | これらの薬剤の血中濃度が上昇し、作用が増強するおそれがある。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| ワルファリン | プロトロンビン時間の延長、著しいINR上昇及び出血傾向(挫傷、鼻出血、消化管出血、血尿、下血等)の報告がある。(「重要な基本的注意」の項参照) | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP2C9を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| フェニトイン イブプロフェン フルルビプロフェン | これらの薬剤の血中濃度上昇の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP2C9を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| セレコキシブ | セレコキシブの血中濃度が上昇することがある。本剤を使用中の患者にはセレコキシブの投与を低用量から開始すること。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP2C9を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ロサルタン | ロサルタンの血中濃度上昇、及び活性代謝物であるカルボン酸体の血中濃度減少の報告がある。 | 本剤はロサルタンの肝臓における主たる代謝酵素であるCYP2C9を阻害するので、併用により活性代謝物であるカルボン酸体の血中濃度が減少することがある。 |
| HMG-CoA還元酵素阻害薬 フルバスタチン | これらの薬剤の血中濃度が上昇することがある。 | 本剤はフルバスタチンの肝臓における主たる代謝酵素であるCYP2C9を阻害するので、併用によりフルバスタチンの血中濃度が上昇することがある。 |
| アトルバスタチン シンバスタチン 等 | これらの薬剤の血中濃度が上昇することがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| カルバマゼピン | カルバマゼピンの血中濃度が上昇し、悪心・嘔吐、めまい、複視等が発現したとの報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ミダゾラム エプレレノン メサドン | これらの薬剤の血中濃度上昇の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| カルシウム拮抗薬 ニフェジピン 等 ビンカアルカロイド系抗悪性腫瘍薬 ビンクリスチン ビンブラスチン エリスロマイシン | これらの薬剤の血中濃度上昇のおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| タクロリムス水和物 シクロスポリン | これらの薬剤の血中濃度上昇の報告がある。 また、併用により腎障害の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| リファブチン | リファブチンのAUC上昇の報告があり、リファブチンの作用が増強するおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| *リトナビル ニルマトレルビル・リトナビル | リトナビルのAUC上昇の報告がある。 ニルマトレルビル・リトナビルの血中濃度上昇のおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| *オキシコドン | オキシコドンのAUC上昇の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| トルバプタン | トルバプタンの血中濃度上昇の報告があり、トルバプタンの作用が増強するおそれがある。やむを得ず併用する際は、トルバプタンを減量あるいは低用量から開始すること。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| イブルチニブ | これらの薬剤の副作用が増強されるおそれがある。やむを得ず併用する際は、これらの薬剤の減量を考慮するとともに、患者の状態を慎重に観察すること。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3Aを阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ラロトレクチニブ | これらの薬剤の副作用が増強されるおそれがある。やむを得ず併用する際は、これらの薬剤の減量を考慮するとともに、患者の状態を慎重に観察すること。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3Aを阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| レンボレキサント | レンボレキサントの血中濃度上昇の報告があり、傾眠等の副作用が増強されるおそれがある。本剤とレンボレキサントの併用にあたっては、患者の状態を慎重に観察した上で、レンボレキサント投与の可否を判断すること。なお、併用する際はレンボレキサントを1日1回2.5mgとすること。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3Aを阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| **バレメトスタット | バレメトスタットの副作用が増強されるおそれがあるので、患者の状態を慎重に観察すること。 | 本剤はこれらの薬剤の主たる代謝酵素であるCYP3Aを阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| フェンタニル | フェンタニルの血中濃度上昇のおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の代謝が遅れることがある。 |
| リバーロキサバン | リバーロキサバンの血中濃度が上昇したとの報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4を阻害するので、併用によりこれらの薬剤の代謝が遅れることがある。 |
| テオフィリン | テオフィリンの血中濃度上昇の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| 経口避妊薬 | エチニルエストラジオール、レボノルゲストレルの血中濃度上昇の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| スルホニル尿素系血糖降下薬(クロルプロパミド、グリベンクラミド 等) | スルホニル尿素系血糖降下薬の血中濃度上昇の報告がある。 また、併用により低血糖の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ナテグリニド | ナテグリニドのAUC上昇及び血中濃度半減期の延長の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| トレチノイン | 中枢神経系の副作用が発現するおそれがある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるチトクロームP450を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| ジアゼパム | ジアゼパムのAUC上昇及び血中濃度半減期の延長の報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4及び2C19を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| トファシチニブ | トファシチニブのAUCが79%、Cmaxが27%増加したとの報告がある。 | 本剤はこれらの薬剤の肝臓における主たる代謝酵素であるCYP3A4及び2C19を阻害するので、併用によりこれらの薬剤の血中濃度が上昇することがある。 |
| シクロホスファミド | ビリルビンの上昇、クレアチニンの上昇の報告がある。 | 本剤はシクロホスファミドの肝臓における主たる代謝酵素であるCYP3A4及び2C9を阻害するので、併用によりシクロホスファミドの血中濃度が上昇することがある。 |
| アブロシチニブ | アブロシチニブの作用が増強するおそれがある。可能な限り本剤を他の類薬に変更する、又は本剤を休薬する等を考慮すること。 | 本剤はアブロシチニブの代謝酵素であるCYP2C19を阻害するので、併用によりアブロシチニブの血中濃度が上昇することがある。 |
| アミトリプチリン ノルトリプチリン | これらの薬剤の作用が増強するおそれがある。 | 本剤はこれらの薬剤の代謝を阻害するので、これらの薬剤の血中濃度が上昇することがある。 |
| ジドブジン | ジドブジンの血中濃度上昇の報告がある。 | 本剤はこれらの薬剤の代謝を阻害するので、これらの薬剤の血中濃度が上昇することがある。 |
| リファンピシン | 本剤の血中濃度の低下及び血中濃度半減期の減少の報告がある。 | リファンピシンは代謝酵素であるチトクロームP450を誘導する。その結果、本剤の肝代謝が増加すると考えられる。 |
| *三酸化二ヒ素 | QT延長、心室頻拍(torsade de pointesを含む)を起こすおそれがある。 | 本剤及び三酸化二ヒ素は、いずれもQT延長、心室頻拍(torsade de pointesを含む)を起こすことがある。 |