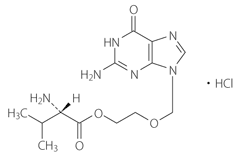
抗ウイルス化学療法剤
1g 106.3円
| 白色〜微黄白色の顆粒剤である。においはないか、わずかに特異なにおいがある。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| プロベネシド | 本剤の活性代謝物のアシクロビルの排泄が抑制され、アシクロビルの平均血漿中濃度曲線下面積(AUC)が48%増加するとの報告がある2)。注) | プロベネシドは尿細管分泌に関わるOAT1及びMATE1を阻害するため、活性代謝物のアシクロビルの腎排泄が抑制されると考えられる(「薬物動態」の項参照)。 |
| シメチジン | 本剤の活性代謝物のアシクロビルの排泄が抑制され、アシクロビルのAUCが27%増加するとの報告がある2)。注) | シメチジンは尿細管分泌に関わるOAT1、MATE1及びMATE2-Kを阻害するため、活性代謝物のアシクロビルの腎排泄が抑制されると考えられる(「薬物動態」の項参照)。 |
| ミコフェノール酸 モフェチル | 本剤の活性代謝物のアシクロビルとの併用により、アシクロビル及びミコフェノール酸 モフェチル代謝物の排泄が抑制され、両方のAUCが増加するとの報告がある3)。注) | 活性代謝物のアシクロビルとミコフェノール酸 モフェチル代謝物が尿細管分泌で競合すると考えられる。 |
| テオフィリン | 本剤の活性代謝物のアシクロビルとの併用により、テオフィリンの中毒症状があらわれることがある4)。 | 機序は不明であるが、本剤の活性代謝物のアシクロビルがテオフィリンの代謝を阻害するためテオフィリンの血中濃度が上昇することが考えられる。 |
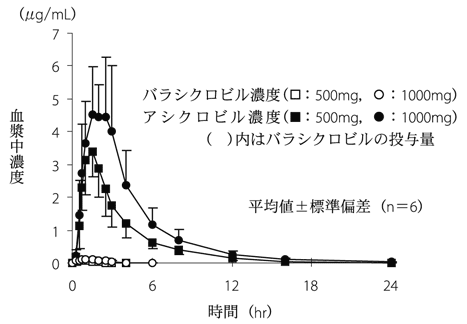
| 投与量 | 例数 | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) Cmax(μg/mL) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) Tmax(hr) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) AUC0-∞(μg・hr/mL) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) t1/2(hr) |
| 500mg | 6 | 3.66±0.83 | 1.50±0.63 | 12.74±2.77 | 2.96±0.41 |
| 1000mg | 6 | 5.84±1.08 | 2.17±0.61 | 22.26±5.73 | 3.55±0.27 |
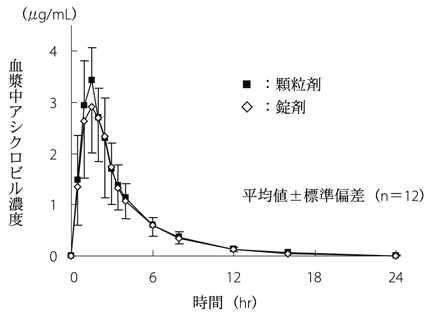
| 投与量 | 投与製剤 | 例数 | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) Cmax(μg/mL) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) Tmax(hr) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) AUC0-∞(μg・hr/mL) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) t1/2(hr) |
| 500mg | 顆粒剤1g | 12 | 3.66±0.73 | 1.63±0.38 | 12.62±2.04 | 3.08±0.53 |
| 500mg | 錠剤1錠 | 12 | 3.70±1.01 | 1.63±0.43 | 11.98±2.51 | 3.27±0.71 |
| 被験者 | 例数 | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) Cmax(μg/mL) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) Tmax注)(hr) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) t1/2(hr) | 単回経口投与時の薬物動態パラメータ(平均値±標準偏差) AUC0-∞(μg・hr/mL) |
| 腎機能障害患者 | 18 | 10.60±4.22 | 2.00(1.00-4.00) | 22.2±5.0 | 249.43±105.09 |
| 被験者 | 例数 | Cmax(μg/mL) | Tmax†(hr) | t1/2(hr) | AUC0-∞(μg・hr/mL) | CL/F(mL/min) |
| 健康成人 | 12 | 4.79±1.24 | 1.50(0.50-2.50) | 2.95±0.36 | 17.40±4.34 | 703±175 |
| 肝機能障害 (中度) | 12 | 7.75±2.45※ | 1.01(0.75-2.50) | 2.93±0.39 | 23.41±5.53※ | 518±117 |
| 肝機能障害 (重度・腹水なし) | 8 | 5.21±1.32 | 1.50(0.75-3.05) | 2.70±0.40 | 22.31±11.56 | 628±254 |
| 肝機能障害 (重度・腹水あり) | 4 | 4.23±2.21 | 1.50(1.00-2.00) | 2.92±0.30 | 19.42±6.99 | 683±336 |
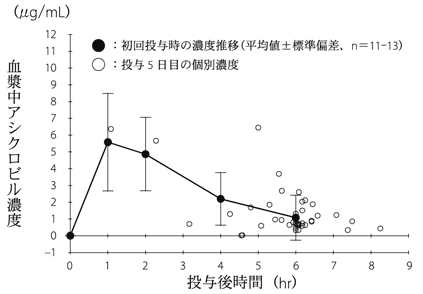
| 投与量(mg/kg) | 年齢(歳) | 例数 | 初回投与時の薬物動態パラメータ Cmax(μg/mL) | 初回投与時の薬物動態パラメータ Tmax†(hr) | 初回投与時の薬物動態パラメータ AUC0-∞(μg・hr/mL) | 初回投与時の薬物動態パラメータ t1/2 (hr) |
| 25 | 1-9 | 11※ | 6.21±2.46 | 1.03(1.00-4.08) | 16.90±6.99 | 1.34±0.29 |