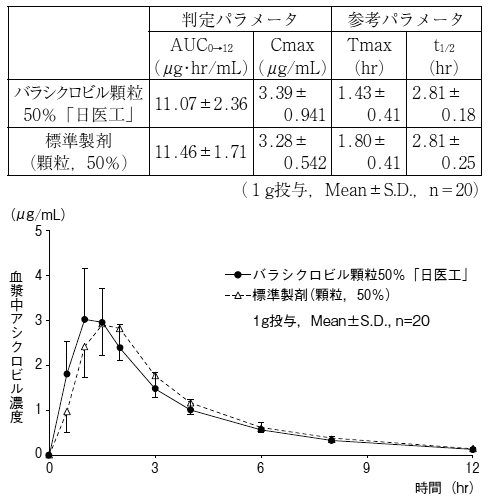
各効能・効果に対し設定された用法・用量で投与した場合,本剤投与時のアシクロビル曝露は,アシクロビル経口製剤投与時よりも高いことから,副作用の発現に留意すること(「重要な基本的注意7」の項参照)。
本剤の投与は,発病初期に近いほど効果が期待できるので,早期に投与を開始すること。なお,目安として,帯状疱疹の治療においては皮疹出現後5日以内に,また,水痘の治療においては皮疹出現後2日以内に投与を開始することが望ましい。
単純疱疹の治療においては,本剤を5日間使用し,改善の兆しが見られないか,あるいは悪化する場合には,他の治療に切り替えること。ただし,初発型性器ヘルペスは重症化する場合があるため,本剤を10日間まで使用可能とする。
成人の水痘の治療においては本剤を5〜7日間,小児の水痘の治療においては本剤を5日間使用し,改善の兆しが見られないか,あるいは悪化する場合には,他の治療に切り替えること。
帯状疱疹の治療においては,本剤を7日間使用し,改善の兆しが見られないか,あるいは悪化する場合には,他の治療に切り替えること。
本剤による性器ヘルペスの再発抑制療法は,性器ヘルペスの発症を繰り返す患者(免疫正常患者においては,おおむね年6回以上の頻度で再発する者)に対して行うこと。また,本剤を1年間投与後,投与継続の必要性について検討することが推奨される。
本剤の活性代謝物であるアシクロビルの曝露量が増加した場合には,精神神経症状や腎機能障害が発現する危険性が高い。腎障害のある患者又は腎機能が低下している患者,高齢者においては,本剤の投与間隔及び投与量を調節し,患者の状態を観察しながら慎重に投与すること。なお,一般に精神神経症状は本剤の投与中止により回復する。(「用法・用量に関連する使用上の注意」及び「過量投与」の項参照)
腎障害のある患者又は腎機能が低下している患者,高齢者,水痘患者等の脱水症状をおこしやすいと考えられる患者では,本剤の投与中は適切な水分補給を行うこと(「高齢者への投与」の項参照)。
水痘の治療において,悪性腫瘍,自己免疫性疾患などの免疫機能の低下した患者に対する有効性及び安全性は確立していない(使用経験がない)。
水痘の治療における本剤の使用経験は少ないため,本剤を水痘の治療に用いる場合には,治療上の有益性と危険性を勘案して投与すること。
意識障害等があらわれることがあるので,自動車の運転等,危険を伴う機械の操作に従事する際には注意するよう患者に十分に説明すること。なお,腎機能障害患者では,特に意識障害等があらわれやすいので,患者の状態によっては従事させないよう注意すること(「用法・用量に関連する使用上の注意」の項参照)。