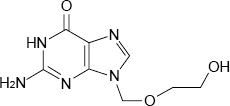
抗ウイルス化学療法剤
1g 139.7円
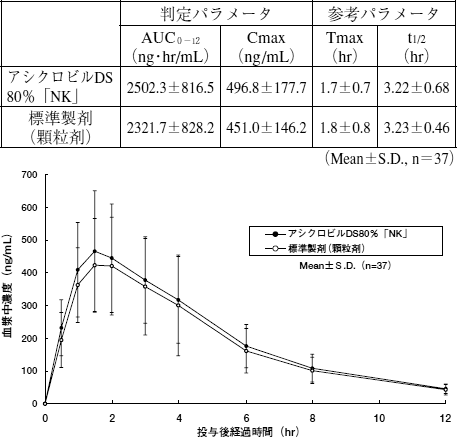
| アシクロビルDS80%「NK」は、白色〜微黄白色の顆粒である。 |
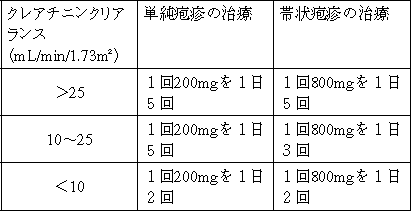
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| プロベネシド | 本剤の排泄が抑制され、本剤の平均血漿中半減期が18%延長し、平均血漿中濃度曲線下面積が40%増加するとの報告がある。注) | プロベネシドは尿細管分泌に関わるOAT1及びMATE1を阻害するため、本剤の腎排泄が抑制されると考えられる。 |
| シメチジン | アシクロビルの排泄が抑制され、アシクロビルの平均血漿中濃度曲線下面積が27%増加するとの報告がある(バラシクロビル塩酸塩でのデータ)。注) | シメチジンは尿細管分泌に関わるOAT1、MATE1及びMATE2-Kを阻害するため、アシクロビルの腎排泄が抑制されると考えられる。 |
| ミコフェノール酸 モフェチル | 本剤及びミコフェノール酸 モフェチル代謝物の排泄が抑制され、両方の平均血漿中濃度曲線下面積が増加するとの報告がある。注) | 本剤とミコフェノール酸 モフェチル代謝物が尿細管分泌で競合すると考えられる。 |
| テオフィリン | 本剤との併用によりテオフィリンの中毒症状があらわれることがある。 | 機序は不明であるが、本剤がテオフィリンの代謝を阻害するためテオフィリンの血中濃度が上昇することが考えられる。 |