1
厚生労働省健康局結核感染症課編: 抗微生物薬適正使用の手引き
2
社内資料: 幼若イヌにおける亜急性毒性(2005年10月11日承認、申請資料概要ニ.6.7.1)
3
社内資料: ラットにおける関節毒性(2005年10月11日承認、申請資料概要ニ.6.7.3)
4
社内資料: イヌにおける亜慢性毒性(2005年10月11日承認、申請資料概要ニ.2.6)
5
社内資料: ラットにおける慢性毒性(2005年10月11日承認、申請資料概要ニ.2.7)
6
社内資料: イヌにおける亜急性毒性(2005年10月11日承認、申請資料概要ニ.2.3)
7
社内資料: イヌにおける眼毒性(2005年10月11日承認、申請資料概要ニ.6.8)
8
大西明弘他: 薬理と治療. 2005; 33: 1029-1045
9
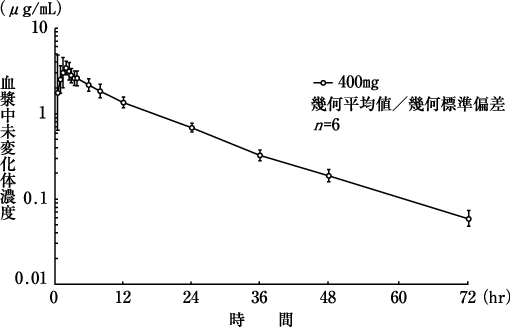
社内資料: 臨床薬理試験/絶対的バイオアベイラビリティー(2005年10月11日承認、申請資料概要ヘ.3.2.4)
10
社内資料: 肺組織への移行(2005年10月11日承認、申請資料概要ヘ.3.2.5)
11
Gehanno P, et al.: J Antimicrob Chemother. 2002; 49: 821-826
12
Muller M, et al.: Antimicrob Agents Chemother. 1999; 43: 2345-2349
13
Siefert HM, et al.: J Antimicrob Chemother. 1999; 43(S-B): 69-76
14
Stass H, et al.: J Antimicrob Chemother. 1999; 43(S-B): 83-90
15
社内資料: ラット、サル及びヒトの肝ミクロゾーム分画における代謝(2005年10月11日承認、申請資料概要ヘ.2.3.2)
16
社内資料: CYP分子種に対する阻害能(2005年10月11日承認、申請資料概要ヘ.2.3.3)
17
Stass H, et al.: Br J Clin Pharmacol. 2002; 53: 232-237
18
社内資料: 透析患者における薬物動態(2005年10月11日承認、申請資料概要ヘ.3.2.7.4)
19
社内資料: 軽~中等度の肝障害患者における薬物動態(2005年10月11日承認、申請資料概要ヘ.3.2.7.1)
20
社内資料: 中等度の肝障害患者における薬物動態(2005年10月11日承認、申請資料概要ヘ.3.2.7.2)
21
社内資料: 臨床薬理試験/QTc延長に対する検討(2005年10月11日承認、申請資料概要ヘ.3.1.5)
22
社内資料: 市中肺炎を対象とした二重盲検比較試験/ブリッジング試験(2005年10月11日承認、申請資料概要ト.1.6.1)
23
社内資料: 呼吸器感染症を対象とした一般臨床試験(2005年10月11日承認、申請資料概要ト.1.6.2)
24
社内資料: 皮膚科領域感染症を対象とした一般臨床試験(2005年10月11日承認、申請資料概要ト.1.6.3)
25
社内資料: 海外第Ⅲ相試験/市中肺炎(2005年10月11日承認、申請資料概要ト.1.5.1)
26
社内資料: 海外第Ⅲ相試験/慢性気管支炎の急性増悪(2005年10月11日承認、申請資料概要ト.1.5.2)
27
社内資料: 海外第Ⅲ相試験/単純性皮膚及び皮膚組織感染症(2005年10月11日承認、申請資料概要ト.1.5.3)
28
社内資料: 海外第Ⅲ相試験/急性副鼻腔炎(2005年10月11日承認、申請資料概要ト.1.5.4)
29
Dalhoff A, et al.: Chemotherapy. 1996; 42: 410-425
30
Schedletzky H, et al.: J Antimicrob Chemother. 1999; 43(S-B): 31-37
31
西野武志他: 日化療会誌. 2005; 53(S-3): 1-15
32
田中香お里他: 日化療会誌. 2005; 53(S-3): 21-26
33
社内資料: クラミジアにおける抗菌力(2005年10月11日承認、申請資料概要ホ.1.1.2.1.4)
34
濱本久美子他: 日化療会誌. 2000; 48: 708-712
35
社内資料: 臨床分離株における抗菌力(2005年10月11日承認、申請資料概要ホ.1.1.2.1.1)