広範囲経口抗菌製剤
1包 50円
| 色調・剤形 | 白色〜微黄白色の小型フィルムコーティング錠 |
|---|---|
| 外形 | 直径約3.2mm×厚さ約3.2mm |
| 識別コード(分包に表示) | MO680 |
| 色調・剤形 | 白色〜微黄白色の小型フィルムコーティング錠 |
|---|---|
| 外形 | 直径約3.2mm×厚さ約3.2mm |
| 識別コード(分包に表示) | MO681 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| フェニル酢酸系又はプロピオン酸系非ステロイド性消炎鎮痛薬 フルルビプロフェン 等 | 痙攣を起こすおそれがある。 | 中枢神経におけるGABAA受容体への結合阻害が増強されると考えられている。 |
| アルミニウム又はマグネシウム含有の制酸薬等、鉄剤 | 本剤の効果が減弱されるおそれがある。これらの薬剤は本剤投与から1〜2時間後に投与する。 | これらの薬剤とキレートを形成し、本剤の吸収が低下すると考えられている。 |
| クマリン系抗凝固薬 ワルファリン | ワルファリンの作用を増強し、プロトロンビン時間の延長が認められたとの報告がある。 | ワルファリンの肝代謝を抑制、又は蛋白結合部位での置換により遊離ワルファリンが増加する等と考えられている。 |
| QT延長を起こすことが知られている薬剤 デラマニド 等 | QT延長を起こすおそれがある。 | 併用によりQT延長作用が相加的に増加するおそれがある。 |
| 副腎皮質ホルモン剤(経口剤及び注射剤) プレドニゾロン ヒドロコルチゾン 等 | 腱障害のリスクが増大するとの報告がある。これらの薬剤との併用は、治療上の有益性が危険性を上回る場合のみとすること。 | 機序不明 |
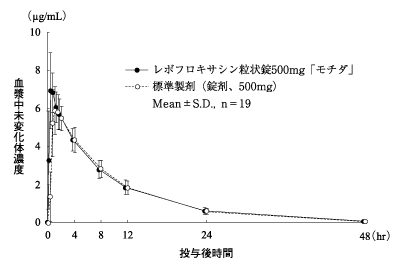
| 判定パラメータ AUC0-48(μg・hr/mL) | 判定パラメータ Cmax(μg/mL) | 参考パラメータ tmax(hr) | 参考パラメータ t1/2(hr) | |
| レボフロキサシン粒状錠500mg「モチダ」 | 67.37±11.23 | 7.61±1.25 | 0.89±0.47 | 7.59±0.65 |
| 標準製剤(錠剤、500mg) | 65.10±9.61 | 6.65±1.01 | 1.32±0.82 | 7.56±0.57 |