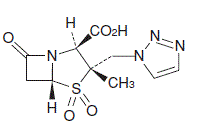
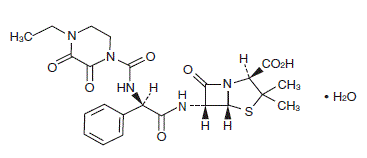
β-ラクタマーゼ阻害剤配合抗生物質製剤
1瓶 591円
| 剤形・性状 | 用時溶解して用いる注射剤で,白色〜微黄白色の塊又は粉末(凍結乾燥品) |
|---|
| 溶 解 液 | 濃度 | pH | 浸透圧比注) |
| 注射用水 | 4.5g(力価)/20mL | 5.7〜5.9 | 約3 |
| 生理食塩液 | 4.5g(力価)/20mL 4.5g(力価)/100mL | 5.6〜5.8 5.3〜5.5 | 約4 約2 |
| 5%(w/v)ブドウ糖注射液 | 4.5g(力価)/20mL 4.5g(力価)/100mL | 5.6〜5.8 5.3〜5.5 | 約4 約2 |
| 剤形・性状 | 用時溶解して用いる注射剤で,白色〜微黄白色の塊又は粉末(凍結乾燥品) |
|---|
| 溶 解 液 | 濃度 | pH | 浸透圧比注) |
| 注射用水 | 4.5g(力価)/20mL | 5.7〜5.9 | 約3 |
| 生理食塩液 | 4.5g(力価)/20mL 4.5g(力価)/100mL | 5.6〜5.8 5.3〜5.5 | 約4 約2 |
| 5%(w/v)ブドウ糖注射液 | 4.5g(力価)/20mL 4.5g(力価)/100mL | 5.6〜5.8 5.3〜5.5 | 約4 約2 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
| プロベネシド | タゾバクタム及びピペラシリンの半減期が延長することがある。 | 腎尿細管分泌の阻害により,プロベネシドがタゾバクタム,ピペラシリンの排泄を遅延させると考えられる。 |
| メトトレキサート | メトトレキサートの排泄が遅延し,メトトレキサートの毒性作用が増強される可能性がある。血中濃度モニタリングを行うなど注意すること。 | 腎尿細管分泌の有機アニオントランスポーター(OAT1,OAT3)阻害により,ピペラシリンがメトトレキサートの排泄を遅延させると考えられる。 |
| 抗凝血薬 (ワルファリン等) | 血液凝固抑制作用を助長するおそれがあるので,凝血能の変動に注意すること。 | プロトロンビン時間の延長,出血傾向等により相加的に作用が増強するものと考えられる。 |
| バンコマイシン | 腎障害が発現,悪化するおそれがある。 | 両薬剤併用時に腎障害が報告されているが,相互作用の機序は不明。 |
| 頻度不明 | |
| 過敏症 | 発疹,蕁麻疹,発赤,紅斑, そう痒,発熱,潮紅,浮腫,水疱性皮膚炎 |
| 血液 | 好酸球増多,白血球減少,好中球減少,顆粒球減少,単球減少,血小板減少,貧血,赤血球減少,ヘマトクリット減少,好中球増多,リンパ球増多,単球増多,血小板増多,出血傾向(紫斑,鼻出血,出血時間延長を含む) |
| 肝臓 | ALT(GPT)上昇,AST(GOT)上昇,γ-GTP上昇,LDH上昇,Al-P上昇,ビリルビン上昇 |
| 消化器 | 下痢,軟便,悪心,嘔吐,食欲不振,便秘,腹部不快感,腹痛,白色便,口内炎,口唇炎,胸やけ,腹部膨満感,下血 |
| 中枢神経 | 痙攣等の神経症状 |
| 菌交代症 | カンジダ症 |
| ビタミン欠乏症 | ビタミンK欠乏症状,ビタミンB群欠乏症状注) |
| その他 | 意識レベル低下,めまい,不眠,頭痛,関節痛,CK(CPK)上昇,クレアチニン上昇,BUN上昇,アンモニア上昇,クロール減少,蛋白尿,尿中ブドウ糖陽性,尿中ウロビリン陽性,動悸,発汗,胸内苦悶感,胸部痛,背部異常感,悪寒,総蛋白減少,アルブミン低下,血糖値低下 |