作成又は改訂年月
**
2018年5月改訂
(第16版)
*
2015年6月改訂
日本標準商品分類番号
薬効分類名
承認等
販売名
ホスホマイシンNa静注用0.5g「タカタ」
販売名コード
承認・許可番号
22500AMX00557
FOSFOMYCIN Na
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
成分・分量
1バイアル中
ホスホマイシンナトリウム0.5g(力価)
添加物
無水クエン酸
性状
| 性状 | 白色の結晶性の粉末 |
|---|
| pH | 6.5〜8.5〔50mg(力価)/mL水溶液〕 |
|---|
| 浸透圧比(生理食塩液に対する比) | 約3〔50mg(力価)/mL水溶液〕 |
|---|
販売名
ホスホマイシンNa静注用1g「タカタ」
販売名コード
承認・許可番号
22500AMX00558
FOSFOMYCIN Na
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
成分・分量
1バイアル中
ホスホマイシンナトリウム:1g(力価)
添加物
無水クエン酸
性状
| 性状 | 白色の結晶性の粉末 |
|---|
| pH | 6.5〜8.5〔50mg(力価)/mL水溶液〕 |
|---|
| 浸透圧比(生理食塩液に対する比) | 約3〔50mg(力価)/mL水溶液〕 |
|---|
販売名
ホスホマイシンNa静注用2g「タカタ」
販売名コード
承認・許可番号
22500AMX00559
FOSFOMYCIN Na
薬価基準収載年月
販売開始年月
貯法・使用期限等
基準名
規制区分
処方箋医薬品
(注意−医師等の処方箋により使用すること)
組成
成分・分量
1バイアル中
ホスホマイシンナトリウム:2g(力価)
添加物
無水クエン酸
性状
| 性状 | 白色の結晶性の粉末 |
|---|
| pH | 6.5〜8.5〔50mg(力価)/mL水溶液〕 |
|---|
| 浸透圧比(生理食塩液に対する比) | 約3〔50mg(力価)/mL水溶液〕 |
|---|
禁忌
効能又は効果
効能又は効果に関連する使用上の注意
**急性気管支炎への使用にあたっては、「抗微生物薬適正使用の手引き」1)を参照し、抗菌薬投与の必要性を判断した上で、本剤の投与が適切と判断される場合に投与すること。
効能又は効果/用法及び用量
〈適応菌種〉
ホスホマイシンに感性のブドウ球菌属、大腸菌、セラチア属、プロテウス属、モルガネラ・モルガニー、プロビデンシア・レットゲリ、緑膿菌
〈適応症〉
敗血症、急性気管支炎、肺炎、肺膿瘍、膿胸、慢性呼吸器病変の二次感染、膀胱炎、腎盂腎炎、腹膜炎、バルトリン腺炎、子宮内感染、子宮付属器炎、子宮旁結合織炎
用法及び用量
[点滴静脈内注射]
通常、成人にはホスホマイシンとして1日2〜4g(力価)、また、小児には1日100〜200mg(力価)/kgを2回に分け、補液100〜500mLに溶解して、1〜2時間かけて静脈内に点滴注射する。
[静脈内注射]
通常、成人にはホスホマイシンとして1日2〜4g(力価)、また、小児には1日100〜200mg(力価)/kgを2〜4回に分け、5分以上かけてゆっくり静脈内に注射する。溶解には日局注射用水又は日局ブドウ糖注射液を用い、本剤1〜2g(力価)を20mLに溶解する。
なお、いずれの場合も年齢、症状により適宜増減する。
用法及び用量に関連する使用上の注意
本剤の使用にあたっては、耐性菌の発現等を防ぐため、原則として感受性を確認し、疾病の治療上必要な最小限の期間の投与にとどめること。
使用上の注意
慎重投与
本人又は両親、兄弟に気管支喘息、発疹、蕁麻疹等のアレルギー症状を起こしやすい体質のある患者
肝障害のある患者[肝障害が悪化するおそれがある。]
重要な基本的注意
本剤によるショック、アナフィラキシーの発生を確実に予知できる方法がないので、次の措置をとること。
事前に既往歴等について十分な問診を行うこと。なお、抗生物質等によるアレルギー歴は必ず確認すること。
投与に際しては、必ずショック等に対する救急処置のとれる準備をしておくこと。
投与開始から投与終了後まで、患者を安静の状態に保たせ、十分な観察を行うこと。特に、投与開始直後は注意深く観察すること。
本剤は14.5mEq/g(力価)のナトリウムを含有するので、心不全、腎不全、高血圧症等ナトリウム摂取制限を要する患者に投与する場合は、注意すること。
副作用
副作用等発現状況の概要
本剤は使用成績調査等の副作用発現頻度が明確となる調査を実施していない。
重大な副作用
ショック、アナフィラキシー
0.1%未満
ショック、アナフィラキシーを起こすことがあるので、観察を十分に行い、胸内苦悶、呼吸困難、血圧低下、チアノーゼ、蕁麻疹、不快感等があらわれた場合には、投与を中止し、適切な処置を行うこと。
偽膜性大腸炎等の血便を伴う重篤な大腸炎
0.1%未満
偽膜性大腸炎等の血便を伴う重篤な大腸炎があらわれることがあるので、観察を十分に行い、腹痛、頻回の下痢があらわれた場合には、直ちに投与を中止し、適切な処置を行うこと。
汎血球減少、無顆粒球症、血小板減少
0.1%未満
汎血球減少、無顆粒球症、血小板減少があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止し、適切な処置を行うこと。
肝機能障害、黄疸
0.1%未満
肝機能障害、黄疸があらわれることがあるので、観察を十分に行い、異常が認められた場合には、投与を中止するなど、適切な処置を行うこと。
痙攣
頻度不明
痙攣があらわれることがあるので、このような症状があらわれた場合には、投与を中止し、適切な処置を行うこと。
その他の副作用
肝臓
0.1〜5%未満
AST(GOT)上昇、ALT(GPT)上昇、Al-P上昇、LDH上昇、γ-GTP上昇、ビリルビン上昇
血液
0.1%未満
貧血、顆粒球減少、白血球減少、好酸球増多
腎臓
0.1%未満
腎機能異常、浮腫、BUN上昇、蛋白尿、電解質異常
消化器
0.1〜5%未満
下痢
消化器
0.1%未満
口内炎、嘔気、嘔吐、腹痛、食欲不振
皮膚
0.1〜5%未満
発疹
皮膚
0.1%未満
紅斑、蕁麻疹、そう痒感
呼吸器
0.1%未満
咳嗽、喘息発作
神経系
0.1%未満
しびれ感、眩暈
投与部位
0.1〜5%未満
血管痛
投与部位
0.1%未満
静脈炎
その他
0.1%未満
頭痛、口渇、発赤、発熱、倦怠感、胸部不快感、胸部圧迫感、心悸亢進
高齢者への投与
本剤は、主として腎臓から排泄される(【薬物動態】の項参照)が、高齢者では、一般に腎機能が低下していることが多く、副作用があらわれやすいので注意すること。特に心不全、腎不全、高血圧症等ナトリウム摂取制限を要する高齢者に投与する場合は、用量に留意するなど注意すること。(「重要な基本的注意」の項参照)
妊婦、産婦、授乳婦等への投与
妊婦又は妊娠している可能性のある婦人には、投与しないことが望ましい。[妊娠中の投与に関する安全性は確立していない。]
小児等への投与
低出生体重児、新生児に対する安全性は確立していない。
適用上の注意
投与経路:静脈内にのみ投与すること。なお、可能な限り点滴静脈内注射により投与することが望ましい。
投与時:静脈内投与により静脈炎、血管痛があらわれることがあるので、注射部位、注射方法に十分注意し、注射速度をできるだけ遅くすること。
その他の注意
長期投与の患者では定期的に肝機能、腎機能、血液検査を行うことが望ましい。
薬物動態
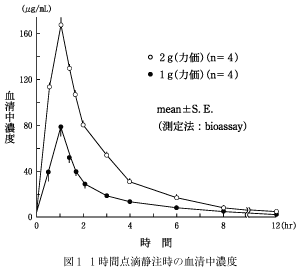
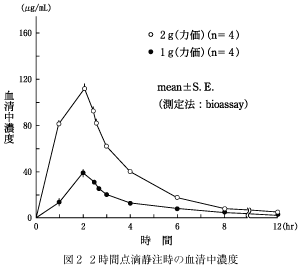
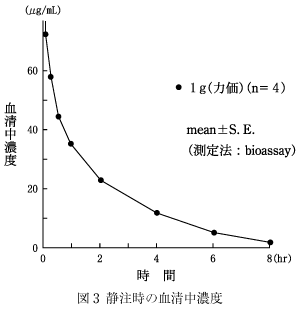
血清中濃度
健康成人男性各4例に注射用ホスホマイシンナトリウム1g(力価)を5%ブドウ糖注射液200mLに溶解し1又は2時間点滴静注したとき、2g(力価)を5%ブドウ糖注射液300mLに溶解し1又は2時間点滴静注したとき、また、1g(力価)を5%ブドウ糖注射液20mLに溶解し5分間かけて静注したときのホスホマイシン血清中濃度の時間的推移は図1〜3のとおりであった。2)
尿中排泄
ホスホマイシンの尿中回収率は、点滴静注後の場合12時間までに87.6±2.9〜95.2±3.3%、静注後の場合は8時間までに93.5±3.4%であった。2)(mean±S.E.)
薬効薬理
抗菌作用
ホスホマイシンナトリウムは、グラム陽性菌、グラム陰性菌に抗菌スペクトルを有し、なかでもセラチア属、プロテウス属、モルガネラ・モルガニー、プロビデンシア・レットゲリ、緑膿菌に抗菌力を示す。3)
作用機序
ホスホマイシンナトリウムは、菌体内に高濃度に取り込まれ、細胞壁合成の初期段階を阻害して殺菌作用を示す。すなわち、PEP(ホスホエノールピルビン酸)と構造が類似しているため、UDP-N-アセチルグルコサミンからUDP-N-アセチルグルコサミンエノールピルビルエーテルへの反応を阻害することにより殺菌作用を示す。4)
有効成分に関する理化学的知見
一般名
ホスホマイシンナトリウム[日局]
Fosfomycin Sodium
略号
FOM
化学名
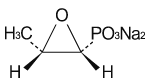
Disodium(2R,3S)-3-methyloxiran-2-ylphosphonate
構造式
分子式
C3H5Na2O4P
分子量
182.02
性状
白色の結晶性の粉末である。
水に極めて溶けやすく、メタノールにやや溶けにくく、エタノール(99.5)にほとんど溶けない。
旋光度
[α]20D:-3.5〜-5.5°(脱水物に換算したもの0.5g、水、10mL、100mm)
pH
0.70gを水10mLに溶かした液のpHは8.5〜10.5である。
取扱い上の注意
安定性試験5,6)
最終包装製品を用いた加速試験(40℃、75%RH、6ヵ月)の結果、3年間安定であることが推測された。
包装
ホスホマイシンNa静注用0.5g「タカタ」
10バイアル(ガラスバイアル)
ホスホマイシンNa静注用1g「タカタ」
10バイアル(ガラスバイアル)
ホスホマイシンNa静注用2g「タカタ」
10バイアル(ガラスバイアル)
主要文献及び文献請求先
主要文献
1
**厚生労働省健康局結核感染症課編:抗微生物薬適正使用の手引き
2
高田製薬(株)社内資料(血清中濃度及び尿中排泄、1990)
3
高田製薬(株)社内資料(MIC分布、1989)
4
Kahan,F.,et al.:Ann.N.Y.Acad.Sci.,235:364,1974.
5
高田製薬(株)社内資料(0.5g:安定性)
6
高田製薬(株)社内資料(1g・2g:安定性)
文献請求先
主要文献に記載の社内資料につきましても下記にご請求下さい。
高田製薬株式会社 学術部
**〒336-8666 さいたま市南区沼影1丁目11番1号
*電話 0120-989-813
**FAX 048-816-4183
製造販売業者等の氏名又は名称及び住所
製造販売
高田製薬株式会社
さいたま市西区宮前町203番地1