1
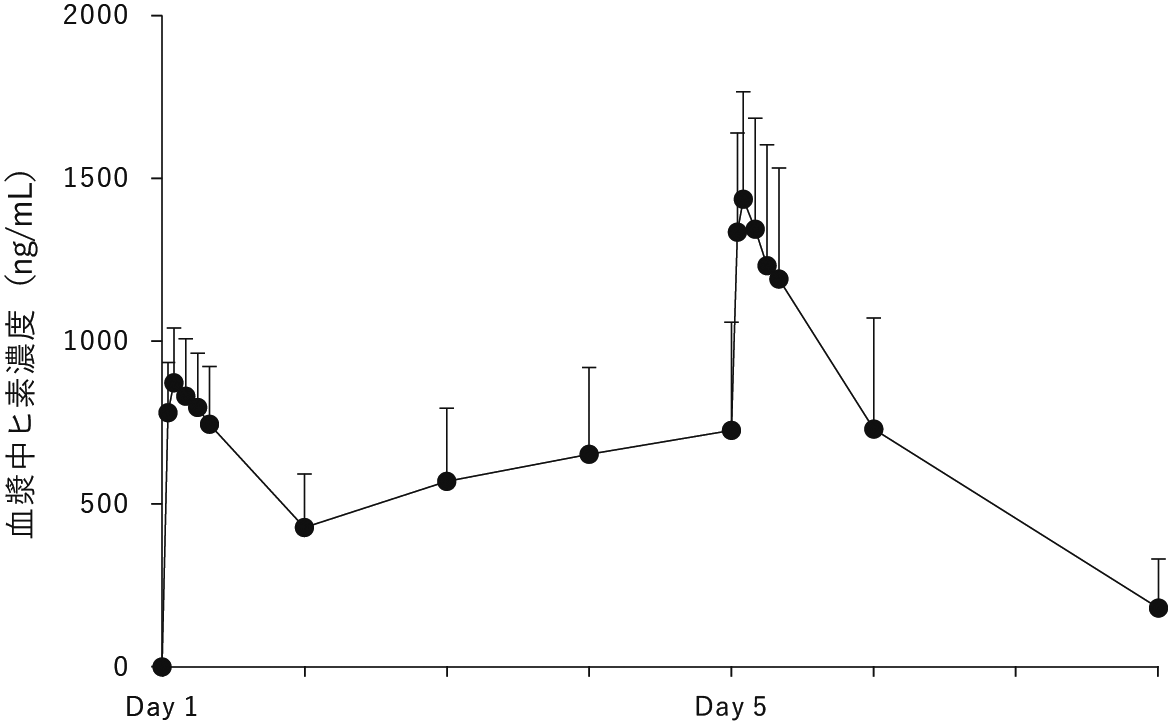
再発又は難治性の末梢性T細胞リンパ腫を対象とした国際共同第II相試験(SP-02L02試験)(2022年6月20日承認、CTD2.7.6.7及び2.7.2.2.2.4)
2
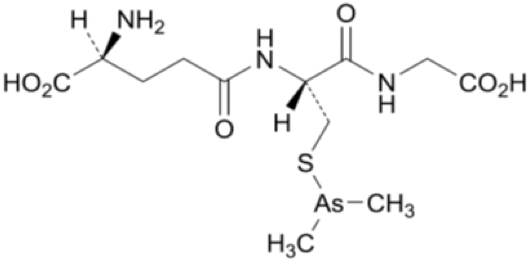
ダリナパルシン及びジメチルアルシン酸のタンパク結合率(175048B及び202905試験)(2022年6月20日承認、CTD2.6.4.4.2)
3
ダリナパルシンの血球移行性(202908試験)(2022年6月20日承認、CTD2.6.4.4.3)
4
ダリナパルシン及びジメチルアルシン酸のCYP誘導試験(PBC473-003試験)(2022年6月20日承認、CTD2.6.4.7.2)
5
Garnier N et al. Mol Pharmacol. 2014; 85: 576-85
6
ダリナパルシンの作用機序(SP02-PD-01、SP02-PD-06及びRES-1002試験)(2022年6月20日承認、CTD2.6.2.2)