抗HER2注1)ヒト化モノクローナル抗体 抗悪性腫瘍剤、注1)HER2:Human Epidermal Growth Factor Receptor Type 2(ヒト上皮増殖因子受容体2型、別称:c-erbB-2)
1瓶 6240円
| 性状 | 白色の粉末又は塊 |
|---|---|
| 剤形 | 注射剤(バイアル) |
| pH | 5.5〜6.3(日局注射用水に溶解後) |
| 浸透圧 | 58〜80mOsm/kg(日局注射用水に溶解後) |
| 溶状 | 澄明又はわずかに乳白光を呈する、無色〜微黄褐色の液である。(日局注射用水に溶解後) |
| 性状 | 白色の粉末又は塊 |
|---|---|
| 剤形 | 注射剤(バイアル) |
| pH | 5.5〜6.3(日局注射用水に溶解後) |
| 浸透圧 | 58〜80mOsm/kg(日局注射用水に溶解後) |
| 溶状 | 澄明又はわずかに乳白光を呈する、無色〜微黄褐色の液である。(日局注射用水に溶解後) |

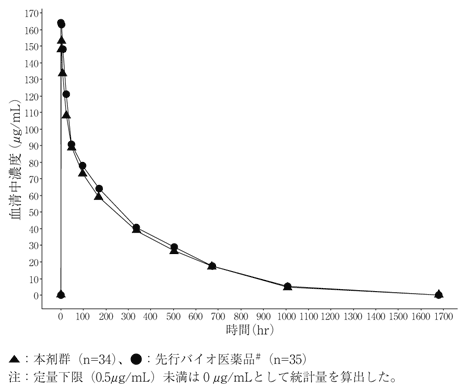
| パラメータ(単位) | パラメータの要約統計量注 本剤(N=34) | パラメータの要約統計量注 先行バイオ医薬品#(N=35) |
| Cmax(μg/mL) | 159±26 | 174±31 |
| AUClast(μg・hr/mL) | 35700±6287 | 38510±6569 |
| AUCinf(μg・hr/mL) | 37130±6305 | 40330±6994 |
| CL(mL/hr/kg) | 0.166±0.026 | 0.153±0.025 |
| Vss(mL/kg) | 56.1±8.2 | 51.7±6.9 |
| t | 213±42 | 220±42 |
| 本剤(N=352) | 先行バイオ医薬品#(N=355) | リスク比(95%信頼区間) | |
| 完全又は部分奏効が認められた被験者数(%) (95%信頼区間) | 220(62.5) (57.2,67.6) | 236(66.5) (61.3,71.4) | 0.940 (0.842,1.049) |
| 症例数 | イベント注2)発現例数(発現率) | ハザード比 | P値 | ||
| 観察期間 中央値 12ヵ月時点 | 対照群 | 1693 | 219(12.9%) | 0.54 | <0.0001 |
| 観察期間 中央値 12ヵ月時点 | 1年投与群 | 1693 | 127(7.5%) | 0.54 | <0.0001 |
| 観察期間 中央値 8年時点 | 対照群注3) | 1697注4) | 570(33.6%) | 0.76 | <0.0001 |
| 観察期間 中央値 8年時点 | 1年投与群 | 1702注4) | 471(27.7%) | 0.76 | <0.0001 |