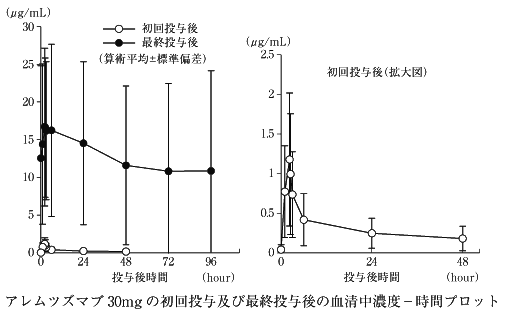
1
社内資料:既治療慢性リンパ性白血病患者における国内臨床試験(2014年9月26日承認、CTD2.7.6.2)
2
社内資料:フルダラビンリン酸エステルに抵抗性かつアルキル化剤による治療歴を有する慢性リンパ性白血病患者における海外第2相試験(2014年9月26日承認、CTD2.7.6.2)
3
社内資料:プリンアナログによる治療歴を有する慢性リンパ性白血病患者における海外第2相試験(2014年9月26日承認、CTD2.7.6.2)
4
社内資料:HLA不一致ドナーからの同種造血幹細胞移植(2020年12月25日承認、CTD2.7.6.2)
5
社内資料:再生不良性貧血に対する同種造血幹細胞移植(2020年12月25日承認、CTD2.7.6.2)
6
社内資料:非臨床概要 緒言(2014年9月26日承認、CTD2.6.1)