1
ブリグチニブのラット6ヶ月間経口投与毒性試験(2021年1月22日承認、CTD 2.6.6.3)
2
ブリグチニブのサル6ヶ月間経口投与毒性試験及び56日間回復性試験(2021年1月22日承認、CTD 2.6.6.3)
3
ブリグチニブのラット胚・胎児発生毒性試験(2021年1月22日承認、CTD 2.6.6.6)
4
ブリグチニブの国内第Ⅱ相試験(2021年1月22日承認、CTD2.7.2.2)
5
ブリグチニブの食事の影響試験(2021年1月22日承認、CTD2.7.1.2)
6
ブリグチニブの海外第Ⅰ/Ⅱ相試験(2021年1月22日承認、CTD 2.7.2.2)
7
ブリグチニブの肝機能障害患者における臨床薬理試験(2021年1月22日承認、CTD 2.7.2.2)
8
ブリグチニブの腎機能障害患者における臨床薬理試験(2021年1月22日承認、CTD 2.7.2.2)
9
ブリグチニブのIn vitro代謝試験(2021年1月22日承認、CTD2.6.4.5)
10
ブリグチニブのマスバランス試験(2021年1月22日承認、CTD 2.7.2.2)
11
ブリグチニブのリファンピシン、イトラコナゾール及びゲムフィブロジルとの臨床薬物相互作用試験(2021年1月22日承認、CTD 2.7.2.2)
12
ブリグチニブのPBPKモデリング&シミュレーション(2021年1月22日承認、CTD 2.7.2.2)
13
ブリグチニブのIn vitro薬物トランスポーター相互作用試験(2021年1月22日承認、CTD 2.6.4.7)
14
ブリグチニブの国内第Ⅱ相試験(2021年1月22日承認、CTD2.7.3.3、2.7.4.2)
15
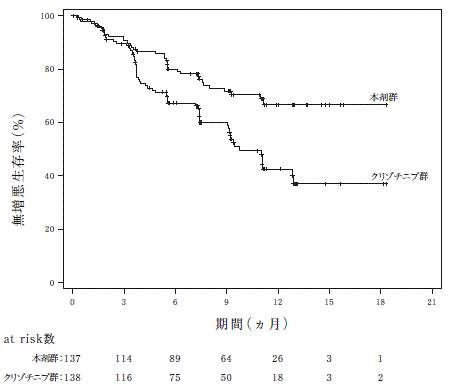
ブリグチニブの海外第Ⅲ相試験(2021年1月22日承認、CTD2.7.3.3、2.7.4.2)
16
ブリグチニブのALK阻害活性評価試験(2021年1月22日承認、CTD 2.6.2.2)