1
社内資料:ラットを用いた胚・胎児発生試験(2019年1月8日承認、CTD 2.6.6.6.2)[L20181214006]
2
社内資料:ラットを用いた6ヵ月間経口投与毒性試験(2019年1月8日承認、CTD 2.6.6.3.2.2)[L20181214007]
3
社内資料:遺伝毒性(2019年1月8日承認、CTD 2.6.6.4)[L20181214008]
4
社内資料:日本人第Ⅰ相試験(2019年1月8日承認、CTD 2.7.2.2.2.5.4)[L20181206041]
5
社内資料:絶対バイオアベイラビリティ試験(2019年1月8日承認、CTD 2.7.1.2.1.3)[L20181206038]
6
社内資料:食事の影響及びラベプラゾールとの薬物相互作用試験(2019年1月8日承認、CTD 2.7.1.2.1.1)[L20181206035]
7
社内資料:In vitro血漿タンパク結合(2019年1月8日承認、CTD 2.6.4.4.4)[L20181214009]
8
社内資料:マスバランス試験(2019年1月8日承認、CTD 2.7.2.2.2.1.1)[L20181206021]
9
社内資料:代謝に関与するCYP分子種(2019年1月8日承認、CTD 2.6.4.5.2.2)[L20181214010]
10
社内資料:肝機能障害の影響検討試験(2019年1月8日承認、CTD 2.7.2.2.2.4.1)[L20181206028]
11
Piscitelli J, et al.:Clin Drug Investig. 2022;42:221-235
12
社内資料:デキストロメトルファンとの薬物相互作用試験(2019年1月8日承認、CTD 2.7.2.2.2.3.3)[L20181206018]
13
社内資料:UGT阻害(2019年1月8日承認、CTD 2.6.4.7.2)[L20181214011]
14
社内資料:トランスポーター阻害(2019年1月8日承認、CTD 2.6.4.7.4.1、2.6.4.7.4.3)[L20181214012]
15
社内資料:パロキセチンとの薬物相互作用試験(2019年1月8日承認、CTD 2.7.2.2.2.3.2)[L20181206019]
16
社内資料:制酸剤との薬物相互作用試験(2019年1月8日承認、CTD 2.7.2.2.2.5.1)[L20181206036]
17
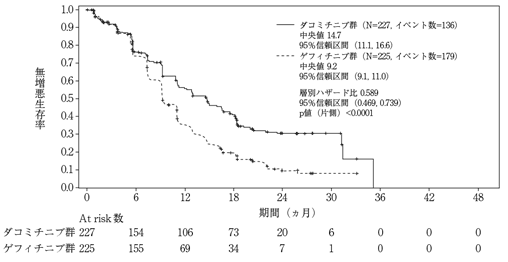
社内資料:国際共同第Ⅲ相試験(非小細胞肺癌)(2019年1月8日承認、CTD 2.7.6.13)[L20181206032]
18
社内資料:抗腫瘍効果及び作用機序に関する試験(in vitro及びin vivo)(2019年1月8日承認、CTD 2.6.2.2.1、2.6.2.2.2)[L20181214013]