1
社内資料:胚・胎児発生に関する試験(2018年9月21日承認、CTD2.6.6.9.1.12)
2
社内資料:遺伝毒性試験(2018年9月21日承認、CTD2.6.6.9.1.13)
3
社内資料:反復投与毒性試験(雄性生殖器に対する影響)(2018年9月21日承認、CTD2.6.6.9.1.5)
4
社内資料:反復投与毒性試験(CYP3A誘導剤との併用)
5
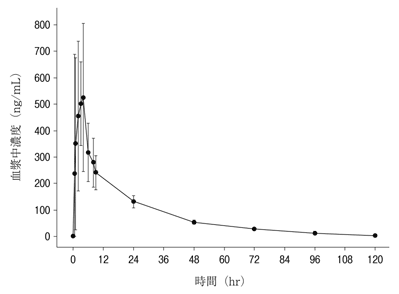
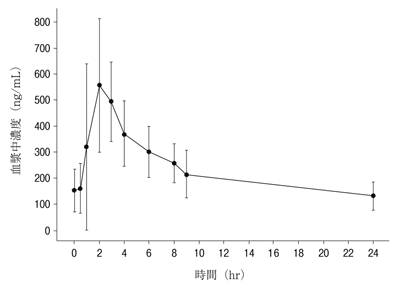
社内資料:日本人癌患者における薬物動態(2018年9月21日承認、CTD2.7.2.2.2.2.1)
6
社内資料:バイオアベイラビリティ(2018年9月21日承認、CTD2.7.1.2.2.1)
7
社内資料:食事の影響(2018年9月21日承認、CTD2.7.1.2.1.2)
8
社内資料:血漿蛋白結合率(2018年9月21日承認、CTD2.7.2.3.2.2)
9
社内資料:ヒトにおける代謝および排泄(in vivo)(2018年9月21日承認、CTD2.7.2.3.2.3.1)
10
社内資料:ヒトにおける代謝(in vitro)(2018年9月21日承認、CTD2.7.2.3.2.3.1)
11
社内資料:腎機能障害を有する被験者における薬物動態
12
社内資料:イトラコナゾールとの薬物相互作用(2018年9月21日承認、CTD2.7.2.2.2.1.3.3)
13
社内資料:リファンピシンとの薬物相互作用(2018年9月21日承認、CTD2.7.2.2.2.1.3.2)
14
社内資料:モダフィニルとの薬物相互作用
15
社内資料:ミダゾラムとの薬物相互作用(2018年9月21日承認、CTD2.7.2.2.2.2.1)
16
社内資料:フェキソフェナジンとの薬物相互作用
17
社内資料:生理学的薬物動態モデルによるシミュレーション
18
社内資料:ラベプラゾールとの薬物相互作用(2018年9月21日承認、CTD2.7.2.2.2.1.3.1)
19
社内資料:薬物相互作用試験(in vitro)(2018年9月21日承認、CTD2.6.4.7)
20
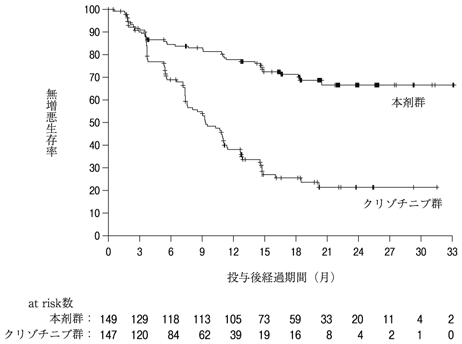
社内資料:国際共同第Ⅲ相試験(B7461006試験)
21
社内資料:国際共同第Ⅰ/Ⅱ相試験(B7461001試験)(2018年9月21日承認、CTD2.7.3.2.3.2.1)
22
社内資料:作用機序に関する試験(2018年9月21日承認、CTD2.6.2.1)
23
社内資料:薬効薬理試験(in vitro)(2018年9月21日承認、CTD2.6.2.2.1)
24
社内資料:薬効薬理試験(in vivo)(2018年9月21日承認、CTD2.6.2.2.2)