1
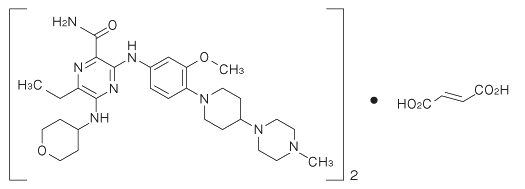
社内報告書:マウス小核試験(2018年9月21日承認 CTD2.6.6.4.3)(DIR180176)
2
社内報告書:ラット胚・胎児発生試験(2018年9月21日承認 CTD2.6.6.6.2)(DIR180172)
3
社内報告書:乳汁中移行・薬物動態(2018年9月21日承認 CTD2.6.4.5.6)(DIR180168)
4
社内報告書:CYP同定・薬物動態(2018年9月21日承認 CTD2.7.2.2.1.3.2)(DIR180170)
5
社内報告書:P-gp基質性・薬物動態(2018年9月21日承認 CTD2.7.2.2.1.5.1)(DIR180171)
6
McMahon, CM. et al.:Blood Advances 2019;3(10):1581‒1585[XSP‒00030]
7
社内報告書:イヌ4週間投与試験(2018年9月21日承認 CTD2.6.6.3.2)(DIR180174)
8
社内報告書:イヌ13週間投与試験(2018年9月21日承認 CTD2.6.6.3.3)(DIR180175)
9
社内報告書:再発又は難治性AML患者・国内第Ⅰ相試験(2018年9月21日承認 CTD2.7.6.8)(DIR180160)
10
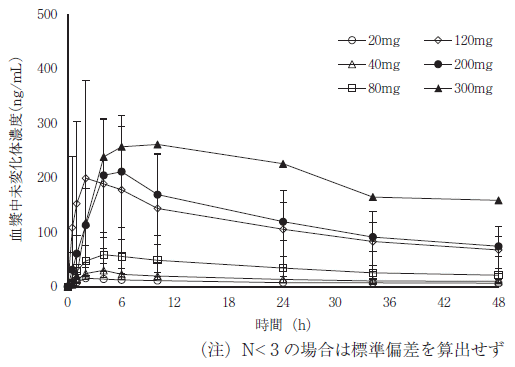
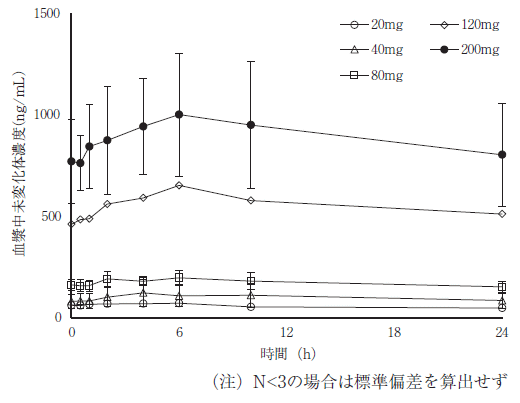
社内報告書:健康被験者・食事の影響試験(2018年9月21日承認 CTD2.7.6.1)(DIR180164)
11
社内報告書:血漿蛋白結合・薬物動態(2018年9月21日承認 CTD2.7.2.2.1.1)(DIR180167)
12
社内報告書:進行性固形癌患者・マスバランス試験(2018年9月21日承認 CTD2.7.6.3)(DIR180169)
13
社内報告書:肝機能正常者及び軽度又は中等度の肝機能障害患者・肝機能障害試験(2018年9月21日承認 CTD2.7.6.4)(DIR180166)
14
社内報告書:健康被験者・薬物相互作用試験(2018年9月21日承認 CTD2.7.6.5)(DIR180165)
15
社内報告書:再発又は難治性AML患者・海外第Ⅰ/Ⅱ相試験(2018年9月21日承認 CTD2.7.6.7)(DIR180158)
16
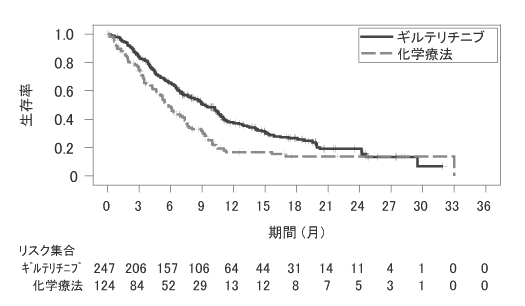
社内報告書:再発又は難治性FLT3遺伝子変異陽性AML患者・国際共同第Ⅲ相試験(2018年9月21日承認 CTD2.7.6.6)(DIR180159)
17
社内報告書:再発又は難治性FLT3遺伝子変異陽性AML患者・国際共同第Ⅲ相試験中間解析(DIR190001)
18
社内報告書:再発又は難治性FLT3遺伝子変異陽性AML患者・国際共同第Ⅲ相試験最終解析(DIR180516)
19
社内報告書:ヒト各種チロシンキナーゼ・薬理作用(2018年9月21日承認 CTD2.6.2.2.1)(DIR180161)
20
社内報告書:変異型ヒトFLT3発現細胞(マウス由来)・薬理作用(2018年9月21日承認 CTD2.6.2.2.2)(DIR180162)
21
社内報告書:ヒトAML細胞・薬理作用(2018年9月21日承認 CTD2.6.2.2.3)(DIR180163)
22
社内報告書:ヒトAML細胞移植ヌードマウス・薬理作用(2018年9月21日承認 CTD2.6.2.2.4)(DIR180173)







 235
235