1
社内資料:胚・胎児発生に関する試験(承認年月日:2012年6月29日、CTD2.6.6.6)[L20120329001]
2
社内資料:ケトコナゾールとの相互作用試験(承認年月日:2012年6月29日、CTD2.7.2.2.2.3.1)[L20120329011]
3
社内資料:リファンピシンとの相互作用試験(承認年月日:2012年6月29日、CTD2.7.2.2.2.3.2)[L20120329012]
4
NDBを用いた調査結果の概要(VEGF/VEGFR阻害作用を有する薬剤の動脈解離に関するリスク評価):https://www.pmda.go.jp/files/000266521.pdf
5
社内資料:反復投与毒性試験(承認年月日:2012年6月29日、CTD2.6.6.3、2.6.6.9)[L20120329002]
6
社内資料:国内第Ⅰ相試験(単回投与)(承認年月日:2012年6月29日、CTD2.7.6(A4061044))[L20120329003]
7
社内資料:国内第Ⅰ相試験(反復投与)(承認年月日:2012年6月29日、CTD2.7.2.2.2.5.3、2.7.6(A4061022))[L20120329004]
8
社内資料:海外静脈内投与試験(承認年月日:2012年6月29日、CTD2.7.1.2.2.1、2.7.6(A4061007))[L20120329005]
9
社内資料:海外最終製剤食事の影響試験 (承認年月日:2012年6月29日、CTD2.7.1.2.1.2、2.7.6(A4061053))[L20120329006]
10
社内資料:in vitro蛋白結合率、血球移行率(承認年月日:2012年6月29日、CTD2.6.4.4)[L20120329007]
11
社内資料:in vitroにおける代謝に関わる分子種の同定(承認年月日:2012年6月29日、CTD2.7.2.3.4.3、2.6.4.5)[L20120329008]
12
社内資料:代謝物の薬理作用(承認年月日:2012年6月29日、CTD2.6.2.2)[L20120329010]
13
社内資料:放射性標識体投与試験(承認年月日:2012年6月29日、CTD2.7.2.2.2.1.1、2.7.6(A4061003))[L20120329009]
14
社内資料:肝機能低下者試験(承認年月日:2012年6月29日、CTD2.7.2.3.4.5.5)[L20120329013]
15
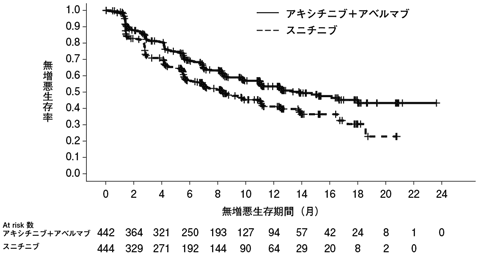
社内資料:第Ⅲ相国際共同試験(腎細胞癌)(承認年月日:2012年6月29日、CTD2.7.6(A4061032))[L20120329014]
16
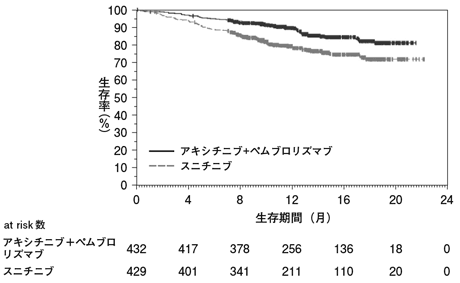
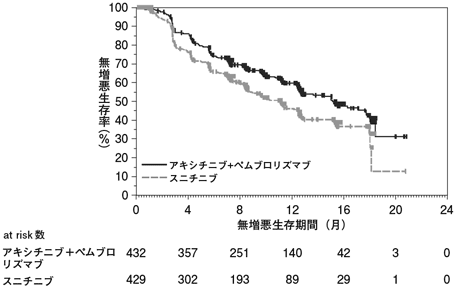
社内資料:国際共同第Ⅲ相試験(B9991003試験)(バベンチオ点滴静注200mg:2019年12月20日承認、CTD2.7.3.3、2.7.6.1)
17
社内資料:薬効薬理試験(承認年月日:2012年6月29日、CTD2.6.2.2)[L20120329016]
18
Mancuso MR, Davis R, et al.:J Clin Invest. 2006;116(10):2610-2621[L20111109024]