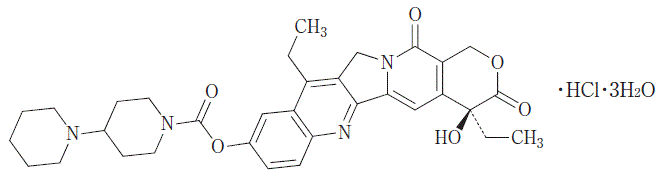
抗悪性腫瘍剤
1瓶 2427円

| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| アタザナビル硫酸塩 (レイアタッツ) | 骨髄機能抑制、下痢等の副作用が増強するおそれがある。 | 本剤の活性代謝物(SN-38)は、主に肝のUDP-グルクロン酸転移酵素1A1(UGT1A1)によりグルクロン酸抱合体(SN-38G)となる。UGT阻害作用のあるアタザナビル硫酸塩との併用により、本剤の代謝が遅延することが考えられる。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 他の抗悪性腫瘍剤 放射線照射 | 骨髄機能抑制、下痢等の副作用が増強するおそれがある。 患者の状態を観察しながら、減量するか又は投与間隔を延長する。 | 併用により殺細胞作用が増強される。 |
| 末梢性筋弛緩剤 | 末梢性筋弛緩剤の作用が減弱するおそれがある。 | 本剤は、動物実験で筋収縮増強作用が認められている。 |
| CYP3A4阻害剤 アゾール系抗真菌剤 ケトコナゾール フルコナゾール イトラコナゾール ミコナゾール 等 マクロライド系抗生剤 エリスロマイシン クラリスロマイシン 等 リトナビル ジルチアゼム塩酸塩 ニフェジピン モザバプタン塩酸塩 等 グレープフルーツジュース | 骨髄機能抑制、下痢等の副作用が増強するおそれがある。 患者の状態を観察しながら、減量するか又は投与間隔を延長する。 | 本剤は、主にカルボキシルエステラーゼにより活性代謝物(SN-38)に変換されるが、CYP3A4により一部無毒化される。CYP3A4を阻害する上記薬剤等との併用により、CYP3A4による無毒化が阻害されるため、カルボキシルエステラーゼによるSN-38の生成がその分増加し、SN-38の全身曝露量が増加することが考えられる。 |
| CYP3A4誘導剤 フェニトイン カルバマゼピン リファンピシン フェノバルビタール 等 セイヨウオトギリソウ(St. John's Wort:セント・ジョーンズ・ワート)含有食品 | 本剤の活性代謝物(SN-38)の血中濃度が低下し、作用が減弱するおそれがある。 本剤投与期間中は上記薬剤・食品との併用を避けることが望ましい。 | 本剤は、主にカルボキシルエステラーゼにより活性代謝物(SN-38)に変換されるが、CYP3A4により一部無毒化される。CYP3A4を誘導する上記薬剤等との併用により、CYP3A4による無毒化が促進されるため、カルボキシルエステラーゼによるSN-38の生成がその分減少し、SN-38の全身曝露量が減少することが考えられる。 |
| ソラフェニブトシル酸塩 | 骨髄機能抑制、下痢等の副作用が増強するおそれがある。 患者の状態を観察しながら、減量するか又は投与間隔を延長する。 | 本剤の活性代謝物(SN-38)は、主に肝のUDP-グルクロン酸転移酵素1A1(UGT1A1)によりグルクロン酸抱合体(SN-38G)となる。UGT1A1阻害作用のあるソラフェニブトシル酸塩との併用により、本剤及び本剤の活性代謝物(SN-38)の血中濃度が上昇する可能性がある。 |
| ラパチニブトシル酸塩水和物 | 骨髄機能抑制、下痢等の副作用が増強するおそれがある。 患者の状態を観察しながら、減量するか又は投与間隔を延長する。 | 機序は不明だが、ラパチニブトシル酸塩水和物との併用により、本剤の活性代謝物(SN-38)のAUCが約40%増加したとの報告がある。 |
| レゴラフェニブ水和物 | 骨髄機能抑制、下痢等の副作用が増強するおそれがある。 患者の状態を観察しながら、減量するか又は投与間隔を延長する。 | 本剤の活性代謝物(SN-38)は、主に肝のUDP-グルクロン酸転移酵素1A1(UGT1A1)によりグルクロン酸抱合体(SN-38G)となる。UGT1A1阻害作用のあるレゴラフェニブ水和物との併用により、本剤及び本剤の活性代謝物(SN-38)のAUCがそれぞれ28%及び44%増加し、Cmaxがそれぞれ22%増加及び9%減少したとの報告がある。 |