1
Nakagawa, K. et al.:Br. J. Cancer, 2006;95:677-682
2
日本人患者における薬物動態(アリムタ注射用:2007年1月4日承認、申請資料概要2.7.2.3)
3
Chay, S. H. et al.:Proc. Amer. Assoc. Cancer Res., 1998;39:524-525
4
組織分布(アリムタ注射用:2007年1月4日承認、申請資料概要2.6.4.4, 2.6.5.5)
5
ヒト血漿におけるin vitro蛋白結合率(アリムタ注射用:2007年1月4日承認、申請資料概要2.7.2.3.1.2)
6
クリアランスと腎機能との関連(アリムタ注射用:2007年1月4日承認、申請資料概要2.7.2.3.4.1.4)
7
薬物動態学的相互作用(アリムタ注射用:2007年1月4日承認、申請資料概要2.7.2.3.5.2.2, 2.7.2.3.3.1)
8
Nakagawa, K. et al.:Jpn. J. Clin. Oncol., 2008;38:339-346
9
臨床試験における安全性の評価結果について(アリムタ注射用:2007年1月4日承認、審査報告書)
10
Vogelzang, N. J. et al.:J. Clin. Oncol., 2003;21:2636-2644
11
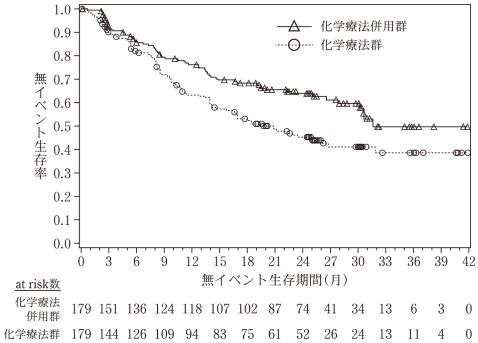
化学療法未治療患者を対象とした外国第Ⅲ相試験①(アリムタ注射用:2007年1月4日承認、申請資料概要2.7.6.1)
12
Ohe, Y. et al.:Clin. Cancer Res., 2008;14:4206-4212
13
Scagliotti, G. V. et al.:J. Clin. Oncol., 2008;26:3543-3551
14
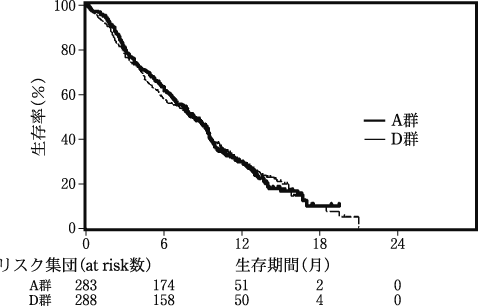
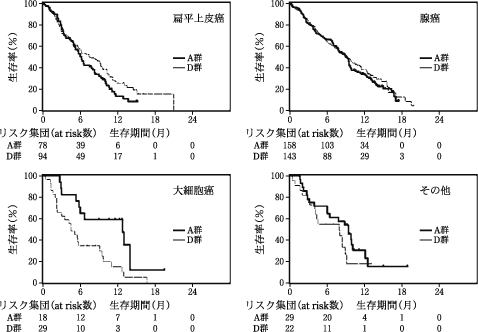
化学療法未治療患者を対象とした外国第Ⅲ相試験②(アリムタ注射用:2009年5月20日承認、審査報告書)
15
Scagliotti, G. V. et al.:The Oncologist, 2009;14:253-263
16
Hanna, N. et al.:J. Clin. Oncol., 2004;22:1589-1597
17
Habeck, L. L. et al.:Mol. Pharmacol., 1995;48:326-333
18
Zhao, R. et al.:Clin. Cancer Res., 2000;6:3687-3695
19
Shih, C. et al.:Cancer Res., 1997;57:1116-1123
20
Britten, C. D. et al.:Cancer Chemother. Pharmacol., 1999;44:105-110
21
シスプラチンとの併用(アリムタ注射用:2007年1月4日承認、申請資料概要2.6.2.5)
22
Chan, D. C. et al.:Proc. Amer. Assoc. Cancer Res., 2006;47:1278
23
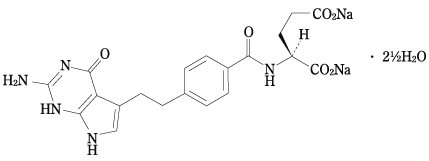
効力を裏付ける試験(アリムタ注射用:2009年5月20日承認、審査報告書)