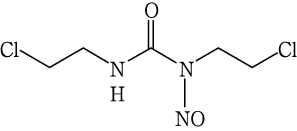
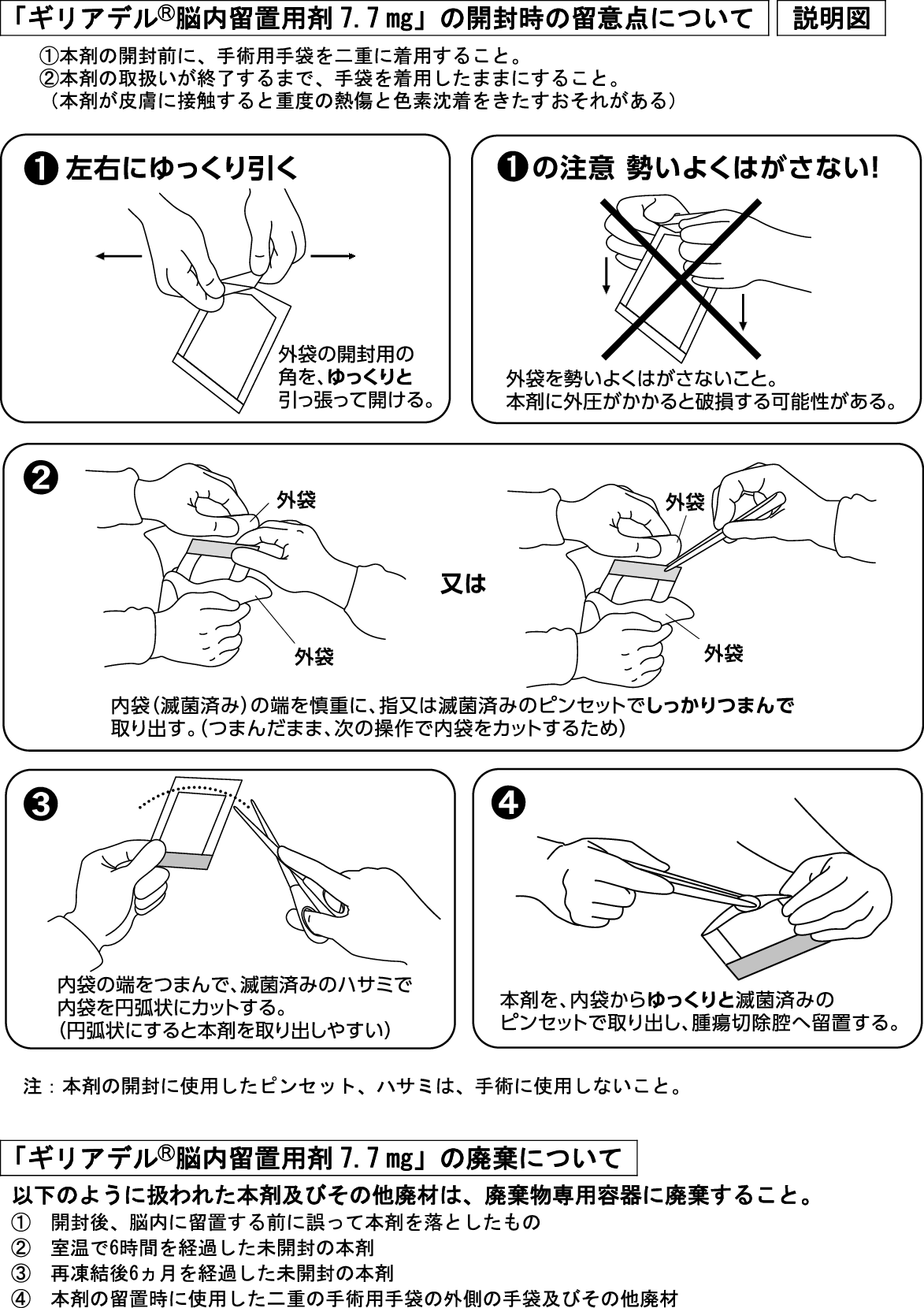
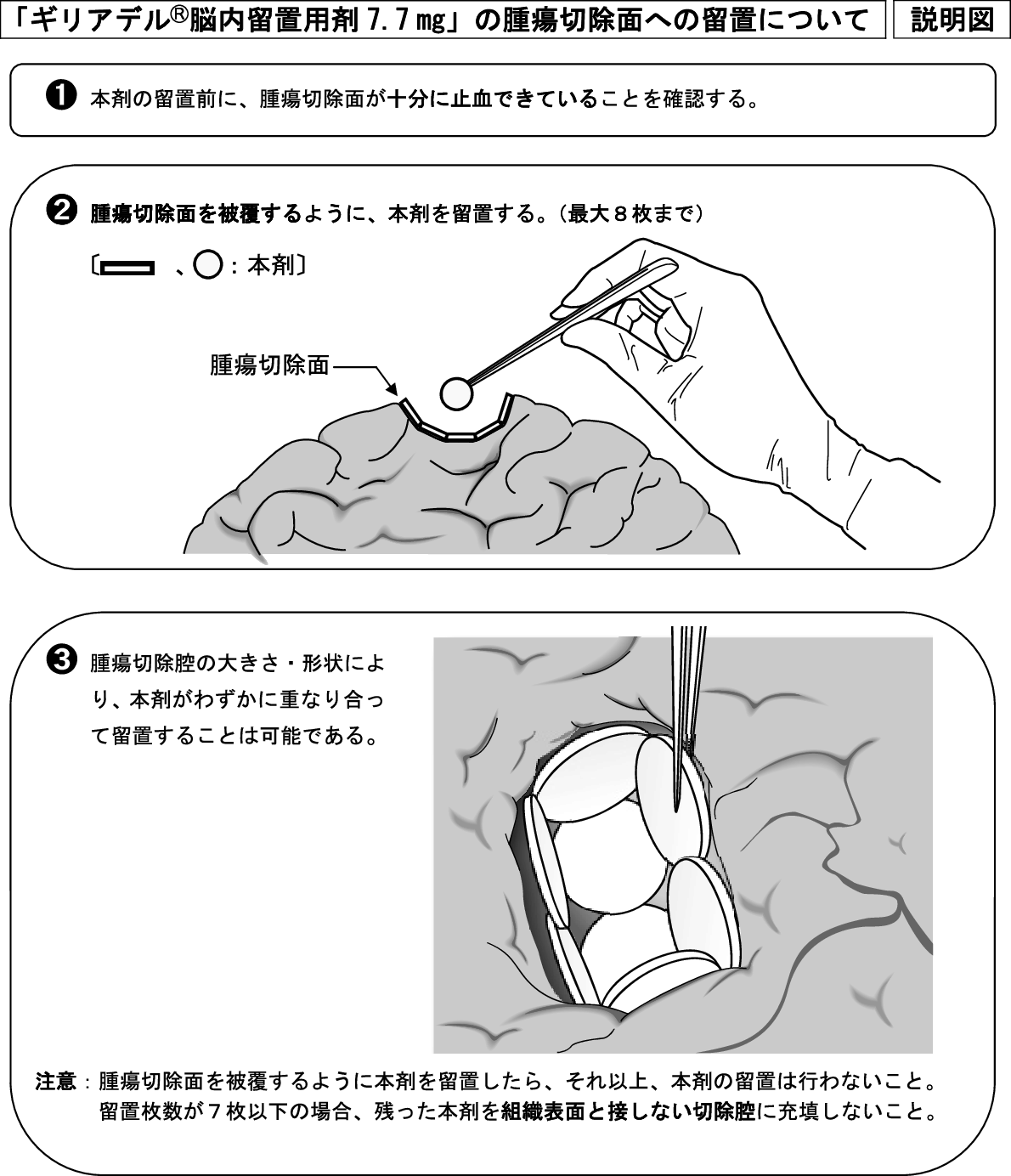
1
Aoki T., et al.:Neurol. Med. Chir.,(Tokyo)2014;54(4):290-301 GLI-0106
2
Fung L.K., et al.:Cancer Res., 1998;58(4):672-684 GLI-0047
3
Loo T.L., et al.:J. Pharm. Sci., 1966;55(5):492-497 GLI-0023
4
社内資料:カルムスチンのヒト肝ミクロソーム、ヒト肝サイトソールに対する影響 GLI-0051
5
DeVita V.T., et al.:Clin. Pharmacol. Ther., 1967;8(4):566-577 GLI-0002
6
社内資料:ラット及びウサギにおけるポリフェプロサン20の薬物動態 GLI-0052
7
Chabner B.A., et al.:Goodman & Gilman’s The pharmacological basis of therapeutics 11th ed., 2006;1324 GLI-0011
8
Tashima M., et al.:Biochem. Pharmacol., 1979;28(4):511-517 GLI-0048
9
Batista L.F.Z., et al.:Cancer Res., 2007;67(24):11886-11895 GLI-0049
10
Xu G.W., et al.:Int. J. Cancer, 2005;116(2):187-192 GLI-0050
11
社内資料:ヒト神経膠芽腫細胞株(U-87MG)の頭蓋内移植モデルに対するカルムスチンの抗腫瘍効果 GLI-0053