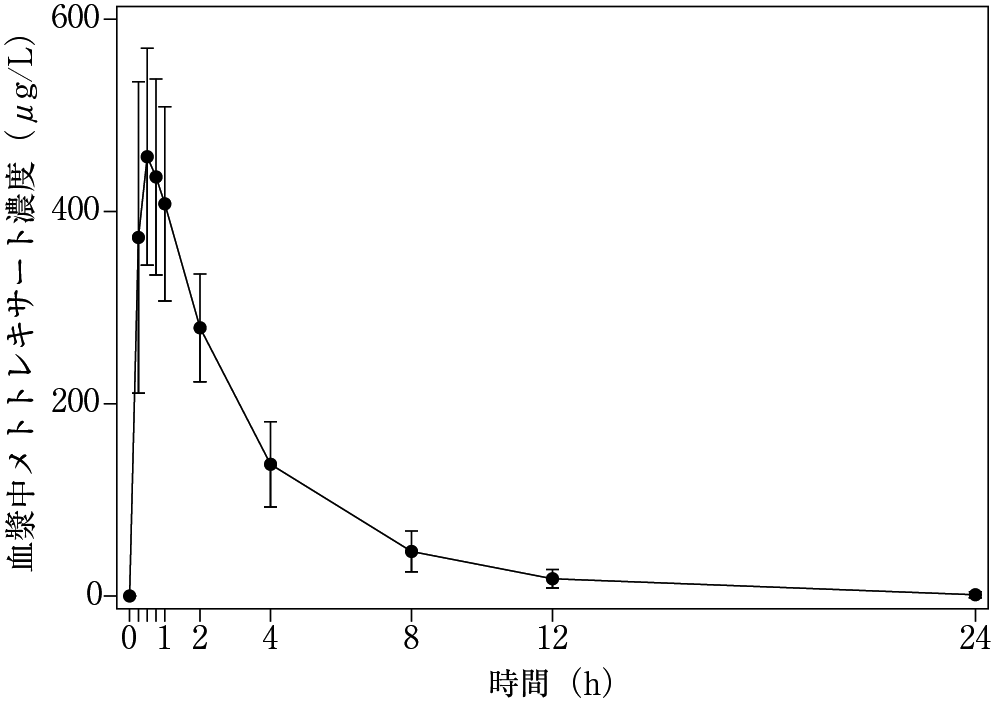
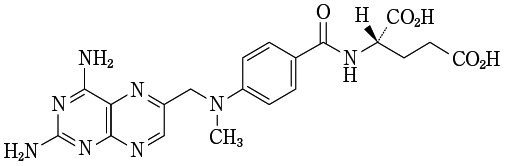
1
社内資料:国内第III相試験(2022年9月26日承認、CTD272)
2
社内資料:海外第I相試験(2022年9月26日承認、CTD271)
3
社内資料:国内第III相試験(2022年9月26日承認、CTD273, 274)
4
Chan ES, et al.: Nat Rev Rheumatol. 2010;6(3):175-8.[MTJ-0050]
5
Bedoui Y, et al.: Int J Mol Sci. 2019;20(20):5023.[MTJ-0051]
6
Friedman B, et al.: Joint Bone Spine. 2019;86(3):301-7.[MTJ-0052]
7
Cronstein BN, et al.: Nat Rev Rheumatol. 2017;13(1):41-51.[MTJ-0025]
8
Cronstein BN, et al.: Nat Rev Rheumatol. 2020;16(3):145-54.[MTJ-0024]
9
Spurlock CF. 3rd, et al.: Rheumatology(Oxford). 2015;54(1):178-87.[MTJ-0035]
10
Spurlock CF. 3rd, et al.: Arthritis Rheum. 2011;63(9):2606-16.[MTJ-0032]
11
Spurlock CF. 3rd, et al.: Arthritis Rheum. 2012;64(6):1780-9.[MTJ-0037]
12
Liu DY, et al.: Biopharm. Drug Dispos. 2013;34:203-14.[MTJ-0036]