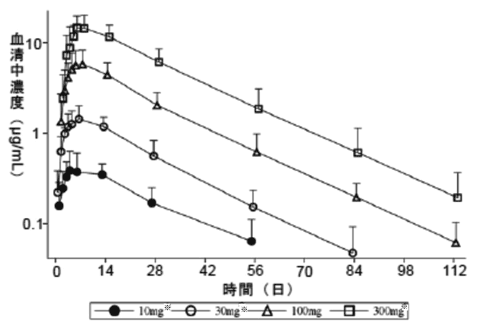
1
社内資料:CNTO1959PSO1002試験(2018年3月23日承認、CTD2.7.6.4)
2
社内資料:CNTO1959PSO3004試験(2018年3月23日承認、CTD2.7.6.7)
3
社内資料:CNTO1959PSO3005試験(2018年3月23日承認、CTD2.7.6.11)
4
社内資料:CNTO1959PPP3001試験(2018年11月21日承認)
5
社内資料:CNTO1959NAP1001試験(2018年3月23日承認、CTD2.7.6.2)
6
社内資料:CNTO1959PSO1003試験(2018年3月23日承認、CTD2.7.6.14)
7
社内資料:CNTO1959PSA2001試験(2018年3月23日承認、CTD2.7.6.6)
8
社内資料:グセルクマブのヒトIL-23への結合親和性(2018年3月23日承認、CTD2.6.2.2)
9
社内資料:ヒトIL-23の中和を介したグセルクマブの作用機序及び機能(2018年3月23日承認、CTD2.6.2.2)