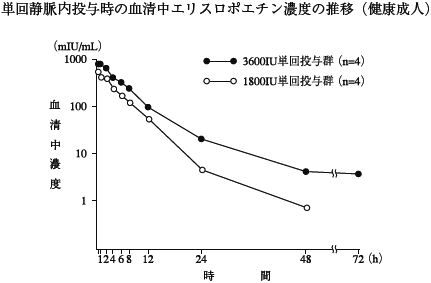
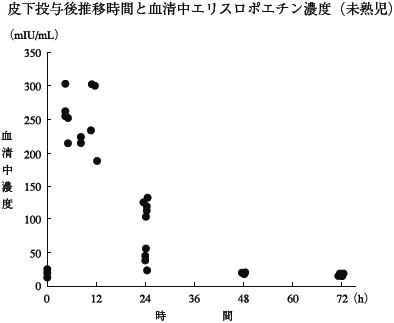
1
Besarab A, et al. N Engl J Med. 1998;339(9):584-90.
2
Singh AK, et al. N Engl J Med. 2006;355(20):2085-98.
3
Pfeffer MA, et al. N Engl J Med. 2009;361(21):2019-32.
4
Leyland-Jones B, et al. J Clin Oncol. 2005;23(25):5960-72.
5
Henke M, et al. Lancet. 2003;362(9392):1255-60.
6
Overgaard J, et al. J Clin Oncol. 2009;27(15s):302s.
7
Luksenburg H, et al. FDA Briefing Document. 2004;ODAC May 4
8
Smith RE Jr, et al. J Clin Oncol. 2008;26(7):1040-50.
9
宇治康明, 他. 診療と新薬. 1989;26(1):1-28.
10
平沢由平, 他. 臨牀透析. 1989;5(3):453-60.
11
未熟児貧血症例の薬物動態 (2006年4月20日承認、申請資料概要 ヘ.3-(2)-1))
12
秋澤忠男, 他. 腎と透析. 2001;50(2):247-57.
13
平沢由平, 他. 腎と透析. 1989;27(2):367-80.
14
杉野信博, 他. 腎と透析. 1992;32(5):795-813.
15
今井信雄, 他. 臨床医薬. 1990;6(Suppl.2):516-25.
16
河村明典, 他. 臨床医薬. 1990;6(Suppl.2):498-506.
17
Kawamura A, et al. Biotherapy. 1990;2(1):77-85.
18
社内資料:ラット慢性腎不全モデルにおける薬理作用 (1988)
19
社内資料:イヌ貧血モデルにおける薬理作用 (1988)
20
社内資料:マウス造血系に及ぼす影響 (1988)