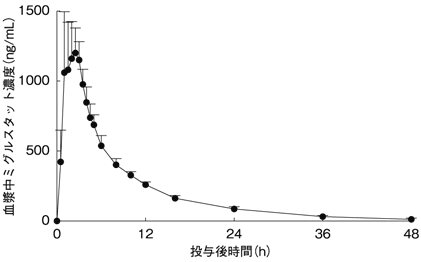
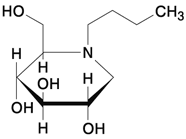
1
社内資料:HIV患者における有効性と安全性(2012年3月30日承認、CTD2.7.4.5.5)
2
van Giersbergen PL, et al.:J Clin Pharmacol. 2007;47:1277-1282
3
社内資料:日本人健康成人における薬物動態(2012年3月30日承認、CTD2.7.2.2.2.1.3)
4
社内資料:ニーマン・ピック病C型患者における薬物動態(2012年3月30日承認、CTD2.7.2.2.2.2)
5
社内資料:ゴーシェ病Ⅲ型患者における脳脊髄液中濃度(2012年3月30日承認、CTD2.7.2.2.2.3.1)
6
社内資料:血漿蛋白及び赤血球とのin vitro結合試験(2012年3月30日承認、CTD2.7.2.2.1.1)
7
社内資料:ヒト肝ミクロソームを用いたin vitro試験(2012年3月30日承認、CTD2.7.2.2.1.3)
8
社内資料:健康成人における[14C]-ミグルスタット経口投与後の吸収及び排泄(2012年3月30日承認、CTD2.7.2.2.2.1.1)
9
社内資料:ファブリー病患者における薬物動態(2012年3月30日承認、CTD2.7.2.2.2.3.4.1)
10
社内資料:日本人ニーマン・ピック病C型患者における臨床試験(2012年3月30日承認、CTD2.7.6.2.16)
11
Patterson MC, et al.:Lancet Neurol. 2007;6:765-772
12
Platt FM, et al.:J Biol Chem. 1994;269:8362-8365
13
Zervas M, et al.:Curr Biol. 2001;11:1283-1287




 4号
4号