1
Barrett CE,et al.:N.Engl.J.Med.2006;355(2):125-137
2
Alison RH,et al.:Toxicol.Patho.1994;22(2):179-186
3
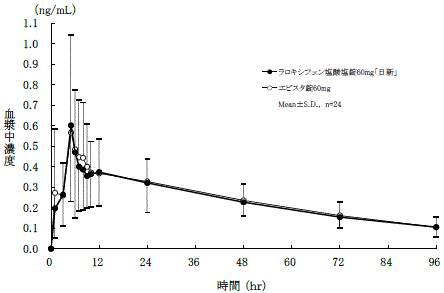
社内資料:生物学的同等性試験
4
腎機能障害患者における薬物動態(エビスタ錠:2004年1月29日承認、申請資料概要ヘ.3.7.2)
5
肝硬変患者における薬物動態(エビスタ錠:2004年1月29日承認、申請資料概要ヘ.3.7.1)
6
コレスチラミン又は制酸剤との相互作用試験(エビスタ錠:2004年1月29日承認、申請資料概要ヘ.3.8.2)
7
アンピシリンとの相互作用試験(エビスタ錠:2004年1月29日承認、申請資料概要ヘ.3.8.1、審査報告書)
8
Brunton,L.L.et al.:グッドマン・ギルマン薬理書 第13版下巻(橋本敬太郎ほか監訳).東京:廣川書店;2022.p1332-1333