
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| 生ワクチン 乾燥弱毒生麻しんワクチン 乾燥弱毒生風しんワクチン 経口生ポリオワクチン等 | 類薬による免疫抑制下で、生ワクチン接種により発症したとの報告がある。 | 免疫抑制作用により発症の可能性が増加する。 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
| アザチオプリン ミゾリビン | 骨髄機能抑制が起こるおそれがある。 | 両剤とも骨髄機能抑制作用が報告されている。 |
| シクロスポリン | 本剤の作用が減弱するおそれがある。 | 併用により、本剤の腸肝循環が阻害され、本剤の血中濃度が低下すると考えられる。 |
| 腸肝循環に影響を与える薬剤 コレスチラミン コレスチミド | 本剤の作用が減弱するおそれがある。 | コレスチラミンとの併用により、本剤のAUCが40%低下したとの報告がある。 |
| マグネシウム及びアルミニウム含有制酸剤 | 本剤の作用が減弱するおそれがある。 | 併用により、本剤の吸収が減少したとの報告がある。 |
| ランソプラゾール | 本剤の作用が減弱するおそれがある。 | 併用により、本剤の吸収が減少したとの報告がある。併用薬によるpHの上昇により、本剤の溶解性が低下すると考えられる。 |
| セベラマー | 本剤の作用が減弱するおそれがある。 | 併用により、本剤のCmaxが30%、AUCが25%低下したとの報告がある。 |
| シプロフロキサシン アモキシシリン・クラブラン酸(合剤) | 本剤の作用が減弱するおそれがある。 | 併用により、本剤のトラフ値が約50%低下したとの報告がある。併用薬により腸内細菌叢が変化することにより、本剤の腸肝循環が阻害され、本剤の血中濃度が低下すると考えられる。 |
| リファンピシン | 本剤の作用が減弱するおそれがある。 | リファンピシンが肝代謝酵素を誘導することにより本剤の代謝が促進され、本剤の血中濃度が低下すると考えられる。 |
| アシクロビル バラシクロビル ガンシクロビル バルガンシクロビル | 本剤の代謝物及びアシクロビル、ガンシクロビルの血中濃度が上昇し、副作用があらわれるおそれがある。 | 腎尿細管での分泌が競合する。 |
| 不活化ワクチン インフルエンザHAワクチン等 | ワクチンの効果を減弱させるおそれがある。 | 本剤の免疫抑制作用により、接種されたワクチンに対する抗体産生が抑制される。 |
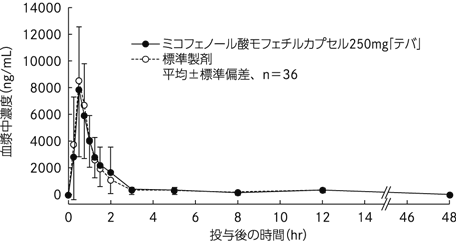
| 投与量 (mg) | AUC0-48 (ng・hr/mL) | Cmax (ng/mL) | Tmax (hr) | T1/2 (hr) | |
| ミコフェノール酸モフェチルカプセル250mg「テバ」 | 250 | 15948±3838 | 9492±3710 | 0.8±0.5 | 19.5±17.8 |
| 標準製剤(カプセル剤、250mg) | 250 | 16239±3324 | 9779±3319 | 0.7±0.4 | 17.9±11.5 |