1
Baxi LV,et al.:Am J Obstet Gynecol. 1993;169(1):33-34
2
Burrows DA,et al.:Obstet Gynecol. 1988;72(3):459-461
3
Lowenstein BR,et al.:Am J Obstet Gynecol. 1988;158(3):589-590
4
Flechner SM,et al.:Am J Kidney Dis. 1985;5(1):60-63
5
Coscia LA,et al.:Best Pract Res Clin Obstet Gynaecol. 2014;28(8):1174-1187
6
エルトロンボパグとの薬物相互作用(レボレード錠:2017.8.25承認、審査報告書)
7
エルトロンボパグとの薬物相互作用(レボレード錠:2017.8.25承認、審査報告書)
8
高原史郎ほか:今日の移植. 1999;12(Suppl.):5-24
9
高原史郎ほか:今日の移植. 1999;12(Suppl.):25-41
10
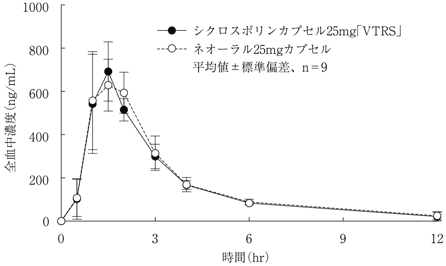
社内資料:生物学的同等性試験(シクロスポリンカプセル25mg「VTRS」)
11
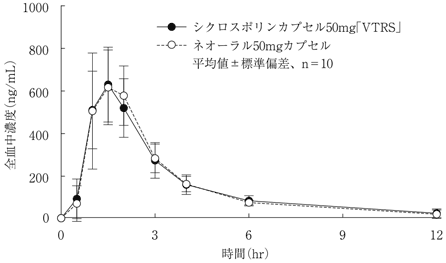
社内資料:生物学的同等性試験(シクロスポリンカプセル50mg「VTRS」)
12
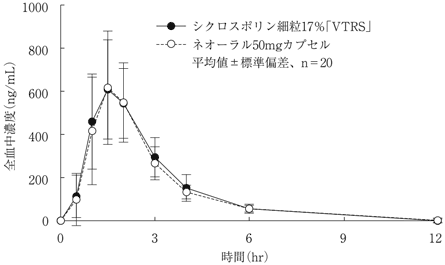
社内資料:生物学的同等性試験(シクロスポリン細粒17%「VTRS」)
13
Kronbach T,et al.:Clin Pharmacol Ther. 1988;43(6):630-635
14
Combalbert J,et al.:Drug Metab Dispos. 1989;17(2):197-207
15
Wood AJ,et al.:Transplant Proc. 1983;15(4)(Suppl.1/2):2409-2412
16
Beveridge T.:Cyclosporin A;Pharmacokinetics and metabolism of Cyclosporin A. 1982;35-44
17
社内資料:溶出試験(シクロスポリンカプセル10mg「VTRS」)
18
打田和治ほか:今日の移植. 1999;12(Suppl.):65-77
19
大島伸一ほか:今日の移植. 1999;12(Suppl.):43-64
20
Eisen HJ,et al.:Transplantation. 1999;68(5):663-671
21
Olivari MT,et al.:Circulation. 1990;82(5/Suppl.IV):276-280
22
Cooper JD,et al.:J Thorac Cardiovasc Surg. 1994;107(2):460-471
23
Palmer SM,et al.:Chest. 1999;116(1):127-133
24
Odorico JS,et al.:Clinical Transplants. 1997;1998:157-166
25
Cantarovich D,et al.:Kidney Int. 1998;54(4):1351-1356
26
Grant D,et al.:Lancet. 1990;335:181-184
27
Jan D,et al.:J Pediatr Surg. 1999;34(5):841-844
28
Fujino Y,et al.:Jpn J Ophthalmol. 1999;43(4):318-326
29
原田昭太郎ほか:西日本皮膚科. 1998;60(6):832-841
30
原田昭太郎ほか:西日本皮膚科. 1998;60(6):842-848
31
溝口秀昭ほか:Biotherapy. 1998;12(11):1459-1472
32
CETB115E1202試験(ネオーラル:2017.8.25承認、審査報告書)
33
CETB115E1201試験(ネオーラル:2017.8.25承認、審査報告書)
34
小山哲夫ほか:腎と透析. 1998;45(6):823-836
35
ネオーラルによるアトピー性皮膚炎治療研究会:臨床皮膚科. 2009;63(1):73-82
36
Liu J,et al.:Cell. 1991;66(4):807-815
37
Clipstone NA,et al.:Nature. 1992;357(6380):695-697
38
Wiesinger D,et al.:Immunobiology. 1979;156(4-5):454-463
39
Andrus L,et al.:Scand J Immunol. 1982;15(5):449-458
40
松本達二ほか:薬理と治療. 1991;19(5):1753-1761
41
Dunn DC,et al.:Transplantation. 1979;27(5):359-361
42
Homan WP,et al.:Surgery. 1980;88(1):168-173
43
Williams JW,et al.:J Surg Res. 1982;32(6):576-585
44
薬理概要(サンディミュン、ネオーラル:2001.6.20承認、申請資料概要 ホ.薬理)
45
Calne RY,et al.:Lancet. 1978;1(8075):1183-1185
46
Norin AJ,et al.:Transplantation. 1982;34(6):372-375
47
McMaster P,et al.:Br Med J. 1980;280(6212):444-445
48
Craddock GN,et al.:Transplantation. 1983;35(4):284-288
49
Nussenblatt RB,et al.:J Clin Invest. 1981;67(4):1228-1231
50
Nakao S,et al.:Exp Hematol. 1995;23(5):433-438
51
Nagamatsu T,et al.:Jpn J Pharmacol. 1992;58(1):27-36
52
NCマウスに対する作用(ネオーラル:2008.10.16承認、CTD2.6.2)