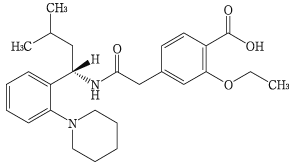
1
健康成人男性における薬物動態(単回投与)(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.4)
2
2型糖尿病患者における薬物動態(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.2.3, 2.7.6.26)
3
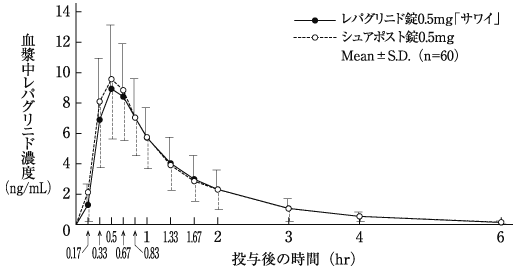
渡辺糺他:新薬と臨床, 2020;69(5):616-627
4
食事による薬物動態への影響(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.16)
5
バイオアベイラビリティ試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.1)
6
血漿タンパク結合率(シュアポスト錠:2011年1月21日承認、申請資料概要2.6.4.4)
7
代謝(シュアポスト錠:2011年1月21日承認、申請資料概要2.6.4.5)
8
健康成人男性におけるレパグリニドの代謝及び排泄(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.10)
9
腎機能障害患者における薬物動態(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.12)
10
肝機能障害患者における薬物動態(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.13)
11
高齢者における薬物動態(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.11)
12
ヒト肝ミクロソームを用いたCYP阻害作用の検討(シュアポスト錠:2011年1月21日承認、申請資料概要2.6.4.7)
13
Niemi, M. et al.:Clin. Pharmacol. Ther., 2005;77:468-478
14
Kajosaari, L. I. et al.:Clin. Pharmacol. Ther., 2005;78:388-399
15
α-グルコシダーゼ阻害剤併用時の薬物動態(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.31)
16
Hoelscher, D. et al.:Clin. Drug Invest., 2008;28:573-582
17
日本人と白人の薬物動態比較試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.14)
18
Kajosaari, L. I. et al.:Eur. J. Clin. Pharmacol., 2006;62:217-223
19
シタグリプチンとの薬物相互作用(シュアポスト錠:2014年11月18日承認、審査報告書)
20
Niemi, M. et al.:Diabetologia, 2003;46:347-351
21
Tornio, A. et al.:Clin. Pharmacol. Ther., 2014;96:498-507
22
Skerjanec, A. et al.:J. Clin. Pharmacol., 2010;50:205-213
23
シメチジンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.17)
24
ケトコナゾールとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.21)
25
リファンピシンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.22)
26
Bidstrup, T. B. et al.:Eur. J. Clin. Pharmacol., 2004;60:109-114
27
シンバスタチンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.24)
28
経口避妊薬との薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.23)
29
ニフェジピンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.25)
30
Niemi, M. et al.:Clin. Pharmacol. Ther., 2001;70:58-65
31
Niemi, M. et al.:Br. J. Clin. Pharmacol., 2004;57:441-447
32
ジゴキシンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.18)
33
ワルファリンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.20)
34
テオフィリンとの薬物相互作用(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.19)
35
社内資料:生物学的同等性試験(錠0.25mg)
36
単剤後期第2相試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.28)
37
単剤長期投与試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.36)
38
単剤実薬対照比較試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.34)
39
Kawamori, R. et al.:J. Diabetes Invest., 2012;3:302-308
40
α-グルコシダーゼ阻害剤併用後期第2相試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.29)
41
α-グルコシダーゼ阻害剤併用長期投与試験(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.37)
42
ビグアナイド系薬剤併用第3相試験(シュアポスト錠:2013年2月28日承認、審査報告書)
43
ビグアナイド系薬剤併用長期投与試験(シュアポスト錠:2014年11月18日承認、審査報告書)
44
チアゾリジン系薬剤併用第3相試験(シュアポスト錠:2013年2月28日承認、審査報告書)
45
チアゾリジン系薬剤併用長期投与試験(シュアポスト錠:2014年11月18日承認、審査報告書)
46
DPP-4阻害剤併用長期投与試験(シュアポスト錠:2014年11月18日承認、審査報告書)
47
河盛隆造他:臨床医薬, 2018;34(3):181-196
48
インスリン製剤併用製造販売後臨床試験(シュアポスト錠:2020年3月18日公表、再審査報告書)
49
Gromada, J. et al.:Diabetologia, 1995;38:1025-1032
50
Fuhlendorff, J. et al.:Diabetes, 1998;47:345-351
51
Hansen, A. M. et al.:Diabetes, 2002;51:2789-2795
52
健康成人男性における薬物動態及び薬力学的特性(反復投与)(シュアポスト錠:2011年1月21日承認、申請資料概要2.7.6.9)
53
レパグリニドの血糖上昇抑制作用(正常ラット)(シュアポスト錠:2011年1月21日承認、申請資料概要2.6.2.2)
54
レパグリニドの血糖上昇抑制作用(Goto-Kakizakiラット)(シュアポスト錠:2011年1月21日承認、申請資料概要2.6.2.2)