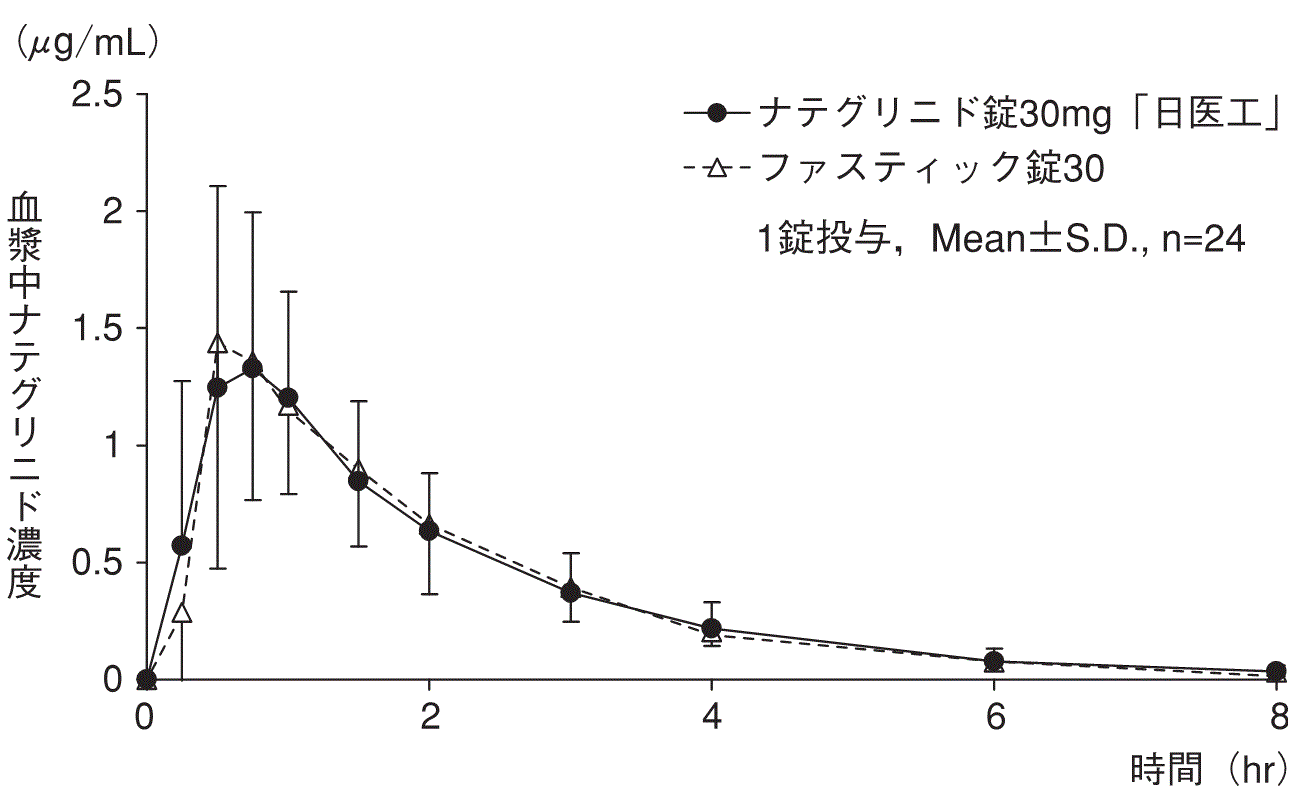
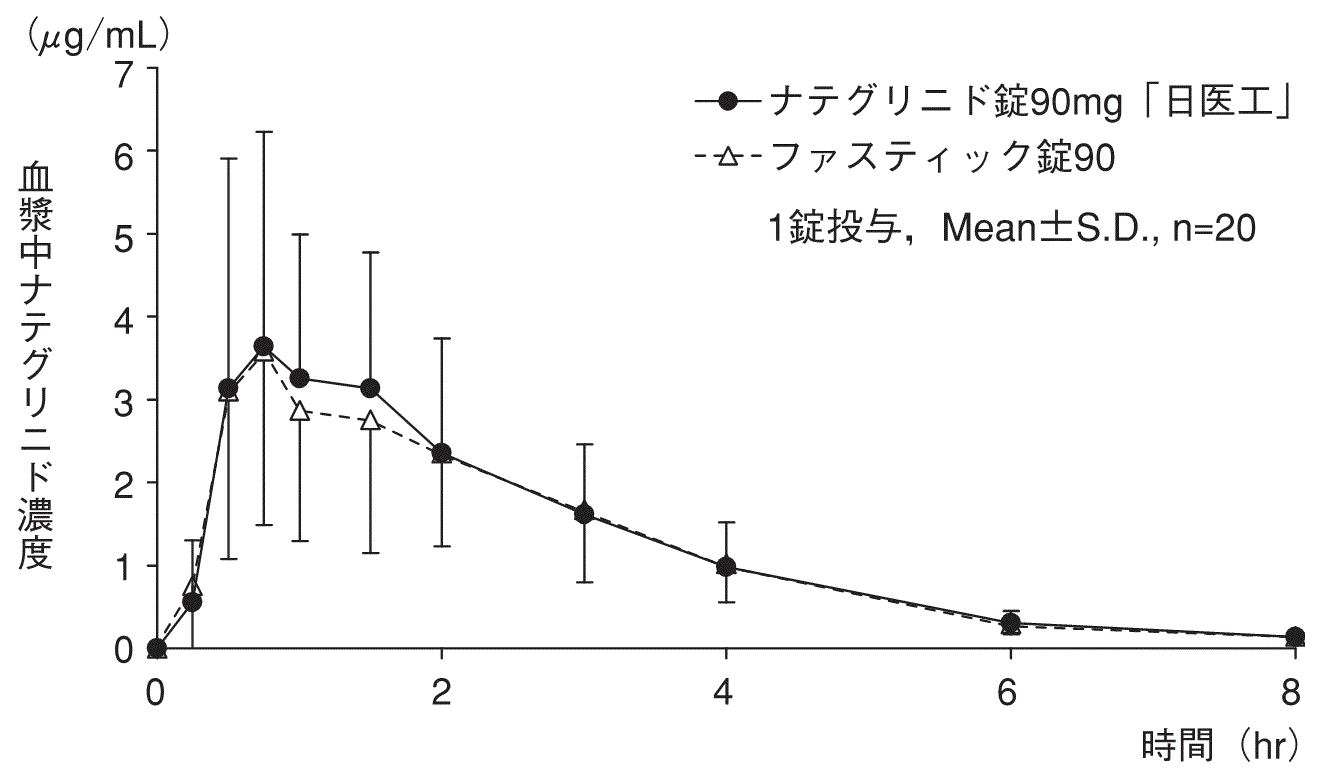
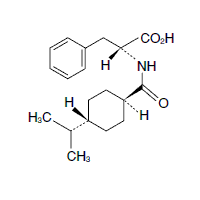
1
小坂樹徳 他:薬理と臨床. 1997;7(5):585-599
2
陶易王 他:診療と新薬. 2013;50(4):369-377
3
小坂樹徳 他:薬理と臨床. 1997;7(5):615-634
4
第十八改正日本薬局方解説書 廣川書店 2021;C3784-C3789
5
三原隆一 他:薬理と治療. 1997;25(Suppl.1):219-228
6
島洋一郎 他:薬理と治療. 1997;25(Suppl.1):181-193
7
三原隆一 他:薬理と治療. 1997;25(Suppl.1):195-205
8
奥山光伸 他:薬理と治療. 1997;25(Suppl.1):207-217
9
菊池方利 他:臨床医薬. 2008;24(8):717-739
10
小坂樹徳 他:薬理と臨床. 1997;7(5):653-668
11
Hirschberg Y., et al.:Diabetes Care. 2000;23(3):349-353
12
江藤隆 他:臨床医薬. 2009;25(1):77-91
13
小坂樹徳 他:薬理と臨床. 1997;7(5):699-727
14
小坂樹徳 他:薬理と臨床. 1997;7(5):797-818
15
葛谷健 他:薬理と臨床. 1997;7(5):819-832
16
垂井清一郎 他:薬理と臨床. 1997;7(5):767-784
17
2型糖尿病患者・第Ⅱ相二重盲検群間比較試験(ファスティック錠・スターシス錠:2007年11月13日、審査報告書)
18
菊池方利:臨床医薬. 2008;24(8):741-760
19
菊池方利 他:臨床医薬. 2009;25(1):35-56
20
菊池方利:臨床医薬. 2009;25(1):57-75
21
Ikenoue T., et al.:Br. J. Pharmacol. 1997;120(1):137-145
22
小坂樹徳 他:薬理と臨床. 1997;7(5):601-614
23
自然発症糖尿病モデルGKラットにおけるAY4166の効果(ファスティック錠・スターシス錠:2007年11月13日、審査報告書)
24
秋吉恵 他:基礎と臨床. 1997;31(5):1725-1735
25
Ikenoue T., et al.:Biol. Pharm. Bull. 1997;20(4):354-359







 466
466