1
生殖発生毒性(ラット)(フェブリク錠:2011年1月21日承認、申請資料概要2.6.6.6)
2
Lehtisalo M, et al.:Clin Transl Sci. 2020;13(6):1236-1243.
3
がん原性(マウス、ラット)(フェブリク錠:2011年1月21日承認、申請資料概要2.6.6.5)
4
血漿中濃度及び排泄(健康成人、単回)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.1)
5
血漿中濃度(健康成人、単回)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.5)
6
血漿中濃度(健康成人、反復)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.8)
7
血漿中濃度(高尿酸血症患者、反復)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.31)
8
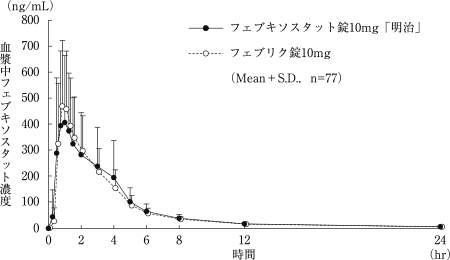
社内資料:フェブキソスタット錠10mg「明治」の生物学的同等性試験に関する資料
9
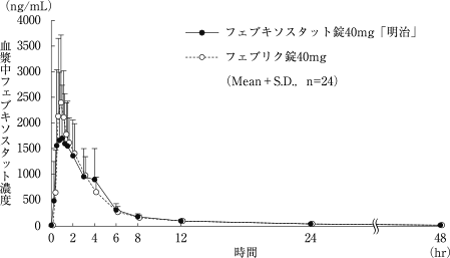
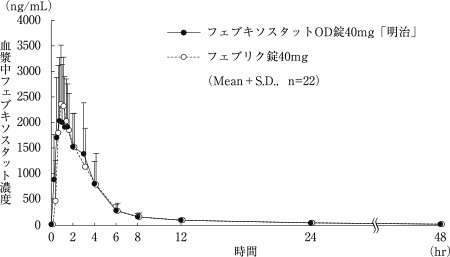
社内資料:フェブキソスタット錠40mg「明治」の生物学的同等性試験に関する資料
10
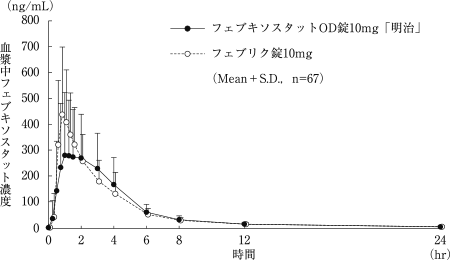
社内資料:フェブキソスタットOD錠10mg「明治」の生物学的同等性試験に関する資料
11
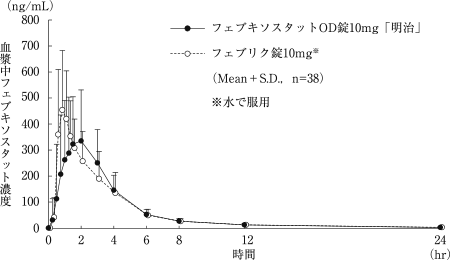
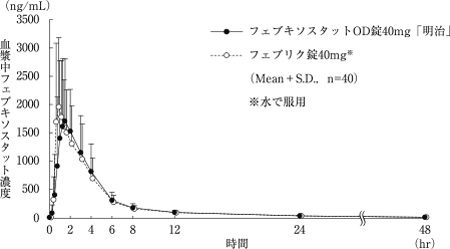
社内資料:フェブキソスタットOD錠40mg「明治」の生物学的同等性試験に関する資料
12
Mukoyoshi M, et al.:Xenobiotica. 2008;38(5):496-510.
13
Grabowski BA, et al.:J Clin Pharmacol. 2011;51(2):189-201.
14
代謝(ヒト)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.2.2.1)
15
血漿中濃度(腎機能低下患者、反復)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.2.3、2.7.6.13)
16
Mayer MD, et al.:Am J Ther. 2005;12(1):22-34.
17
Khosravan R, et al.:J Clin Pharmacol. 2006;46(1):88-102.
18
Khosravan R, et al.:J Clin Pharmacol. 2008;48(9):1014-1024.
19
Khosravan R, et al.:Br J Clin Pharmacol. 2008;65(3):355-363.
20
薬物相互作用(制酸剤)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.20)
21
薬物相互作用(コルヒチン)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.18、2.7.6.19)
22
Khosravan R, et al.:J Clin Pharmacol. 2006;46(8):855-866.
23
薬物相互作用(デシプラミン)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.16)
24
薬物相互作用(ワルファリン)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.23、2.7.6.24)
25
Grabowski BA, et al.:Br J Clin Pharmacol. 2010;70(1):57-64.
26
薬物相互作用(テオフィリン)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.25)
27
薬物相互作用(ロシグリタゾン)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.26)
28
社内資料:フェブキソスタット錠20mg「明治」の溶出性(生物学的同等性試験)に関する資料
29
社内資料:フェブキソスタットOD錠20mg「明治」の溶出性(生物学的同等性試験)に関する資料
30
プラセボ対照無作為化二重盲検用量反応比較試験(痛風を含む高尿酸血症患者)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.33)
31
アロプリノール対照無作為化二重盲検比較試験(痛風を含む高尿酸血症患者)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.35a)
32
アロプリノール対照二重盲検比較試験(フェブリク錠:2011年1月21日承認、審査報告書)
33
長期投与試験(痛風を含む高尿酸血症患者)(フェブリク錠:2011年1月21日承認、申請資料概要2.7.6.40)
34
Tamura K, et al.:Int J Clin Oncol. 2016;21(5):996-1003.
35
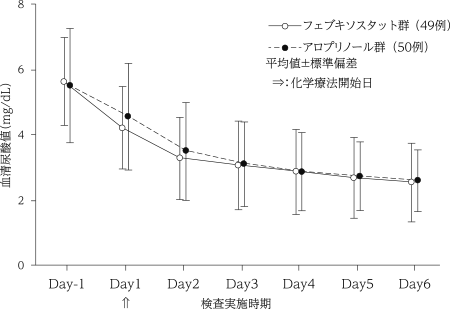
アロプリノール対照非盲検無作為化比較試験(フェブリク錠:2016年5月23日承認、申請資料概要2.7.6.2)
36
Takano Y, et al.:Life Sci. 2005;76(16):1835-1847.
37
血中及び尿中尿酸低下作用(ラット)(フェブリク錠:2011年1月21日承認、申請資料概要2.6.2.2.2)