1
小林道也ほか:TDM研究. 1993;10(2):166-171
2
有馬正高ほか:基礎と臨床. 1992;26(3):1093-1107
3
太田裕一郎ほか:株式会社ツムラ社内資料
4
Sone, H. et al. :Hepatology. 1996;23(4):764-770
ウィルソン病(D-ペニシラミンに不耐性である場合)治療剤
1カプセル 293.3円
有効成分 | 1カプセル中 日局トリエンチン塩酸塩 250mg |
|---|---|
添加剤 | カプセル内容物:日局ステアリン酸 |
| 剤形 | 硬カプセル剤 |
|---|---|
| 色調 | キャップ:淡褐色 ボディ:淡褐色 |
| 号数 | 1 |
| 識別コード | 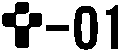 |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
経口鉄剤 | 本剤の作用が減弱するおそれがある。経口鉄剤の投与を受けた患者に本剤を投与する場合には、2時間以上の間隔をあけることが望ましい。 | 本剤が鉄剤中の鉄と結合し、本剤と銅との結合を阻害する。 |
他剤・食物(軽食等) | 本剤の作用が減弱するおそれがある。 | 本剤の吸収が妨げられるおそれがある。 |
0.1~5%未満 | |
|---|---|
過敏症 | 発疹 |
精神神経系 | 頭痛、振戦等 |
消化器 | 嘔気、胸やけ、胃不快感等 |
血液 | 白血球減少、貧血(鉄欠乏性貧血、鉄芽球性貧血等) |
有用性 | 投与期間 24週以上 | 投与期間 12週以上 |
極めて有用 | 61.9%(13/21) | 62.5%(5/8) |
かなり有用以上 | 95.2%(20/21) | 87.5%(7/8) |
やや有用以上 | 100.0%(21/21) | 100.0%(8/8) |