1
加藤隆一 他:臨床薬理. 1989;20(3):515-527
2
健康成人男子における第I相臨床試験-1日2回反復投与試験-(ケアロードLA錠/ベラサスLA錠;2007年10月19日承認、申請資料概要 2.7.6)
3
健康成人男子における第I相臨床試験-単回投与試験:食事の影響-(ケアロードLA錠/ベラサスLA錠;2007年10月19日承認、申請資料概要 2.7.6)
4
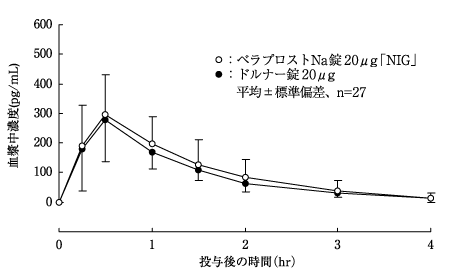
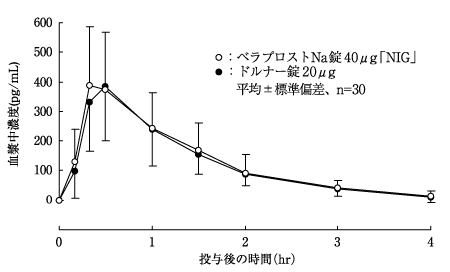
社内資料:生物学的同等性試験
5
再審査報告書(ドルナー錠/プロサイリン錠;2012年12月19日)
6
Nishio, S. et al. :Japan. J. Pharmacol. 1988;47(1):1-10
7
西尾伸太郎 他:日本薬理学雑誌. 1989;94(6):351-361
8
Umetsu, T. et al. :Japan. J. Pharmacol. 1987;43(1):81-90
9
Umetsu, T. et al. :Arzneim. -Forsch. /Drug Res. 1989;39(1):68-73
10
Kajikawa, N. et al. :Arzneim. -Forsch. /Drug Res. 1989;39(4):495-499