1
Packer, M. et al.:New Engl J Med.1991;325(21):1468-1475
2
Cohn, J. N. et al.:New Engl J Med.1998;339(25):1810-1816
3
西大條亮一 ほか:医薬品研究.1985;16(5):1053-1072
4
江崎孝三郎 ほか:医薬品研究.1985;16(5):1073-1092
5
Akiyama, H. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1124-1132
6
Bramer, S. L. et al.:Clin Pharmacokinet.1999;37(Suppl.2):69-77
7
永野耕一 ほか:医薬品研究.1985;16(6):1268-1284
8
永野耕一 ほか:医薬品研究.1985;16(6):1305-1324
9
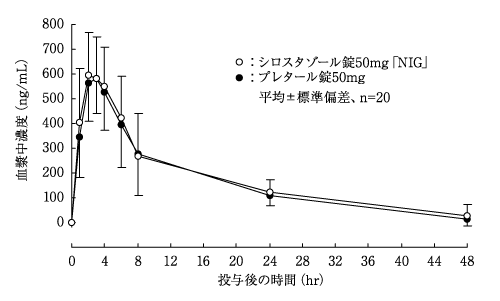
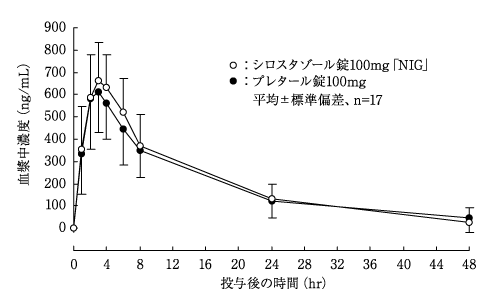
社内資料:生物学的同等性試験
10
Akiyama, H. et al.:Arzneim-Forsch/Drug Res.1985;35(II):1133-1140
11
第十八改正日本薬局方 医薬品情報 JPDI2021. じほう;2021:339-340
12
臨床薬理試験成績(プレタール錠;2003年4月16日承認、申請資料概要ト.1.(5)1))
13
Mallikaarjun, S. et al.:Clin Pharmacokinet.1999;37(Suppl.2):33-40
14
Bramer, S. L. et al.:Clin Pharmacokinet.1999;37(Suppl.2):25-32
15
Mallikaarjun, S. et al.:Clin Pharmacokinet.1999;37(Suppl.2):79-86
16
Suri, A. et al.:Clin Pharmacokinet.1999;37(Suppl.2):61-68
17
ケトコナゾール及びグレープフルーツジュースとの併用投与試験(プレタール錠;2003年4月16日承認、申請資料概要ト.1.(5)1))
18
ジルチアゼムとの併用投与試験(プレタール錠;2003年4月16日承認、申請資料概要ト.1.(5)1))
19
Suri, A. et al.:Clin Pharmacokinet.1999;37(Suppl.2):53-59
20
脳梗塞患者における再発のリスク軽減効果の検討(プレタール錠;2003年4月16日承認、申請資料概要ト.1.(3))
21
第十八改正日本薬局方解説書. 廣川書店;2021:C-2469-C-2474