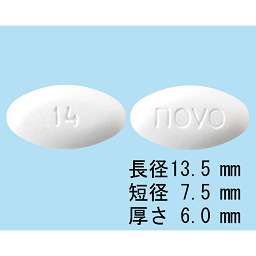
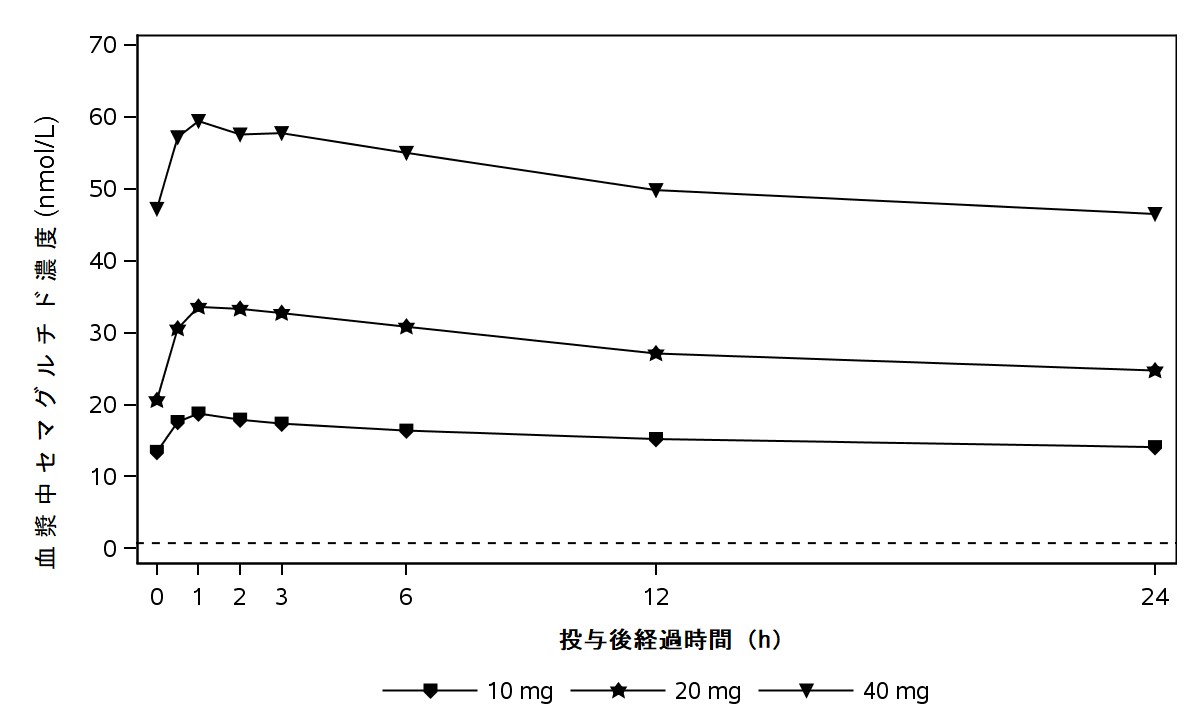
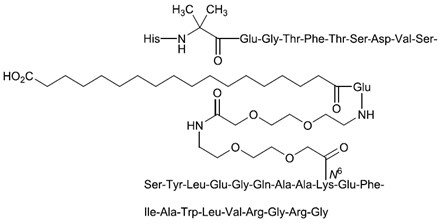
1
社内資料:ラットを用いた受胎能及びEFD試験(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.6.6.1)
2
社内資料:ウサギを用いたEFD試験(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.6.6.2)
3
社内資料:カニクイザルを用いたEFD試験(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.6.6.3)
4
社内資料:カニクイザルを用いたEFD及びPPND試験(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.6.6.3)
5
社内資料:ラットを用いた104週間反復皮下投与がん原性試験(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.6.5)
6
社内資料:マウスを用いた104週間反復皮下投与がん原性試験(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.6.5)
7
Buckley S.T., et al.:Sci Transl Med. 2018;10(467).eaar7047
8
社内資料:サルカプロザートナトリウムの毒性試験(2020年6月29日承認, CTD2.4.5.4)
9
社内資料:サルカプロザートナトリウムの薬物動態試験(2020年6月29日承認, CTD2.4.5.3)
10
社内資料:第I相臨床試験(NN9924-4140)(2020年6月29日承認, CTD2.7.2.3)
11
社内資料:第I相臨床試験(NN9924-4154)(2020年6月29日承認, CTD2.7.2.3)
12
社内資料:第I相臨床試験(NN9924-3794)(2020年6月29日承認, CTD2.7.2.3)
13
社内資料:第I相臨床試験(NN9924-3957)(2020年6月29日承認, CTD2.7.2.3)
14
Marbury T.C., et al.:Clin Pharmacokinet. 2017;56(11):1381-90
15
Jensen L., et al.:Diabetes Obes Metab. 2018;20(4):998-1005
16
Jensen L., et al.:Eur J Pharm Sci;2017;104:31-41
17
社内資料:酵素誘導(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.4.7)
18
社内資料:酵素阻害(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.4.7)
19
社内資料:トランスポーター阻害(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.4.7)
20
Granhall C., et al.:Clin Pharmacokinet. 2018;57(12):1571-80
21
Bækdal T.A., et al.:J Clin Pharmacol. 2018;58(10):1314-23
22
Bækdal T.A., et al.:Clin Pharmacokinet. 2019;58(9):1193-203
23
社内資料:第I相臨床試験(NN9924-4249)(2020年6月29日承認, CTD2.7.2.3)
24
社内資料:第I相臨床試験(NN9924-4250)(2020年6月29日承認, CTD2.7.2.3)
25
社内資料:第I相臨床試験(NN9924-4279)(2020年6月29日承認, CTD2.7.2.3)
26
Bækdal T.A., et al.:Expert Opin Drug Metab Toxicol. 2018;14(8):869-77
27
Yamada Y., et al.:Lancet Diabetes Endocrinol. 2020;8(5):377-91
28
Aroda V.R., et al.:Diabetes Care. 2019;42(9):1724-32
29
Rosenstock J., et al.:JAMA. 2019;321(15):1466-80
30
Pratley R., et al.:Lancet. 2019;394(10192):39-50
31
Zinman B., et al.:Diabetes Care. 2019;42(12):2262-71
32
Yabe D., et al.:Lancet Diabetes Endocrinol. 2020;8(5):392-406
33
社内資料:db/dbマウスにおける体重、摂餌量、血糖及びβ細胞容積ならびに機能への影響(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.2.2.2.3)
34
Kapitza C., et al.:Diabetologia, 2017;60(8):1390-9
35
社内資料:第I相臨床試験(NN9535-3684)(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.5.3.4)
36
社内資料:摘出灌流ラット膵臓からのインスリン分泌(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.2.2.1.2)
37
社内資料:ミニブタのインスリン分泌に及ぼす薬理作用持続時間の検討(オゼンピック皮下注2mg:2018年3月23日承認, CTD2.6.2.2.2.4)
38
Blundell J., et al.:Diabetes Obes Metab. 2017;19(9):1242-51