1
Herings RMC, et al.:Lancet. 1995;345:1195-8
2
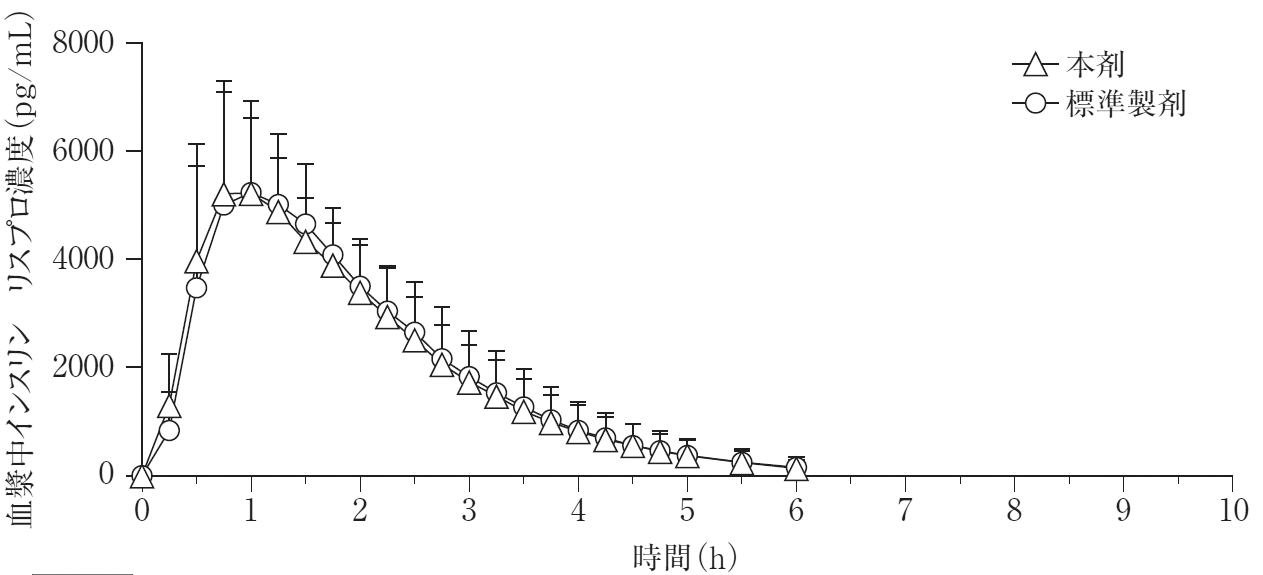
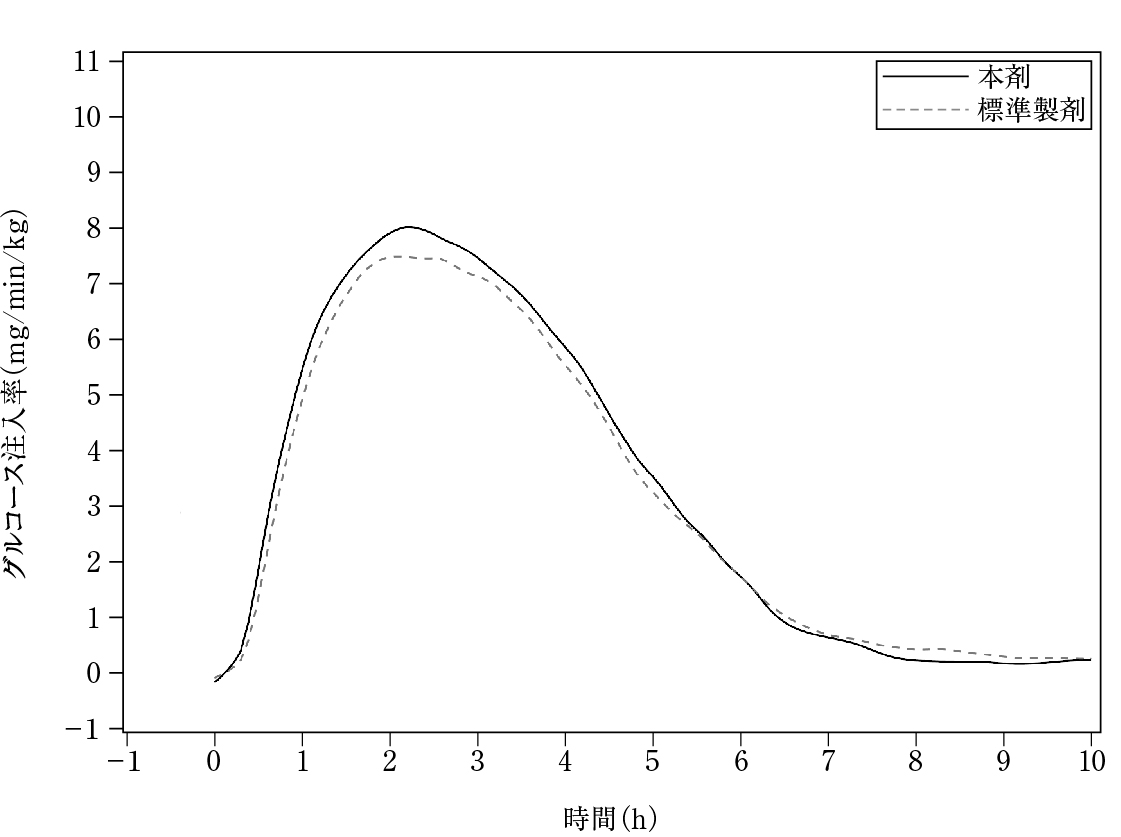
社内資料:日本人健康成人正常血糖クランプ試験(2020年3月25日承認、CTD2.7.6)
3
浦江明憲 他:臨床医薬. 2000;16(11):1601-11
4
Edith W, et al.:Diabetes Care. 1996;19(12):1437-40
5
Heinemann L, et al.:Diabetic Medicine. 1996;13:625-9
6
社内資料:国際共同第III相試験(1型糖尿病)(2020年3月25日承認、CTD2.7.6)
7
葛谷 健 他:臨床医薬. 2000;16(11):1613-30
8
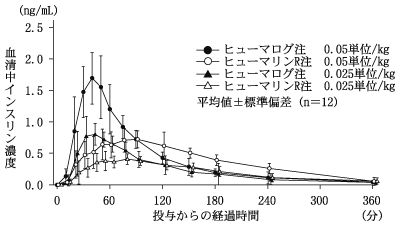
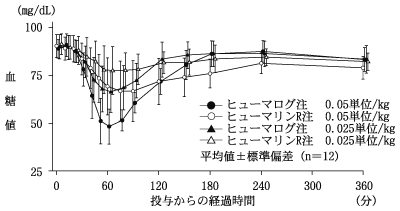
ヒューマログ注の社内資料:ヒューマログ注の単独投与と基礎インスリン製剤との併用投与データ
9
石井 均 他:臨床医薬. 2000;16(11):1631-48
10
葛谷 健 他:臨床医薬. 2000;16(11):1649-64
11
松浦信夫 他:臨床医薬. 2000;16(11):1665-76
12
Anderson JH, et al.:Diabetes. 1997;46:265-70
13
Anderson JH, et al.:Arch Intern Med. 1997;157:1249-55
14
Brunelle RL, et al.:Diabetes Care. 1998;21(10):1726-31
15
中澤隆弘 他:日本臨床. 1997;55,糖尿病(2):293-7
16
社内資料:外国人1型糖尿病正常血糖クランプ試験(2020年3月25日承認、CTD2.7.6)
17
Slieker LJ, et al.:Diabetologia. 1997;40:S54-61
18
Radziuk JM, et al.:Diabetes. 1997;46:548-56
19
Ebeling P, et al.:Diabetes Care. 1997;20(8):1287-9
20
Jansson PA, et al.:Diab Nutr Metab. 1998;11:194-9