1
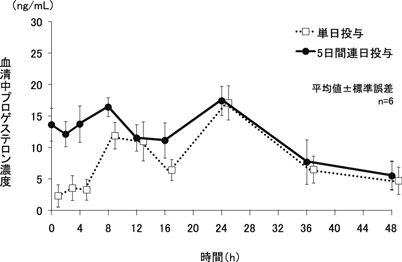
社内資料:外国人女性を対象とした薬物動態試験(2014年9月26日承認、CTD 2.7.6.2)
2
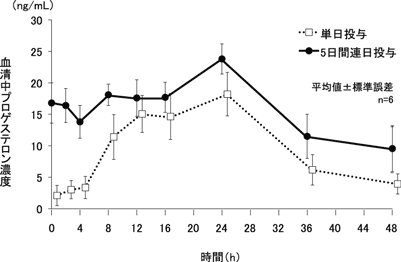
社内資料:日本人女性を対象とした第Ⅲ相試験(2014年9月26日承認、CTD 2.7.6.4)
3
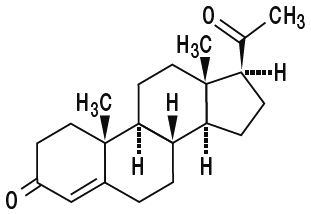
Pfeifer SM, Strauss JF III. Progestins. In: Adashi EY, Rock JA, Rosenwaks Z (eds). Reproductive Endocrinology, Surgery and Technology. Philadelphia: Lippincott-Raven. 1996 : 493-504.
4
Adlercreutz H et al.: J Steroid Biochem 1980; 13(2): 231-244.
5
Kumar, N., Koide, S.S., Tsong, Y., Sundaram, K. Nestorone®: a progestin with a unique pharmacological profile. Steroids. 2000; 65: 629-636.
6
Anderson, L., Martin, W., Higgins, C., Nelson, S.M., Norman, J.E. The effect of progesterone on myometrial contractility, potassium channels, and tokolytic efficacy. Reprod Sci. 2009; 16: 1052-1061.