1
Watanabe A. et al.:J Toxicol. Sci., 37(3), 617(2012)
2
社内資料:健康成人男性での単回投与試験
3
社内資料:健康高齢女性での臨床薬理試験(QT/QTc間隔に及ぼす影響の検討)
4
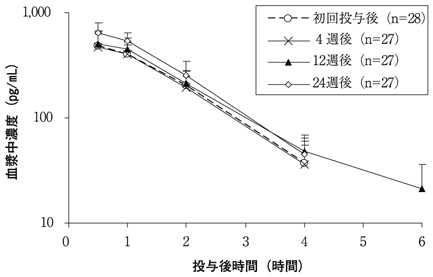
社内資料:骨粗鬆症患者での臨床薬理試験(24週間反復投与時の薬物動態の検討)
5
社内資料:健康成人男性での単回静脈内投与試験
6
Serada M. et al.:Xenobiotica, 42(4), 398(2012)
7
社内資料:薬物動態試験<血球移行性(in vitro)>
8
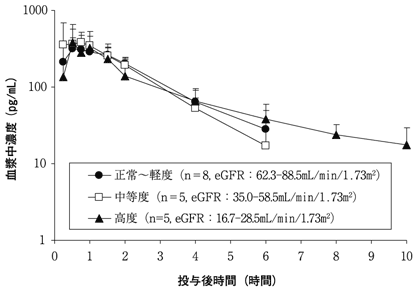
社内資料:腎機能障害者での臨床薬理試験
9
社内資料:薬物動態試験<酵素阻害(in vitro)>
10
社内資料:薬物動態試験<酵素誘導(in vitro)>
11
社内資料:骨折リスクの高い原発性骨粗鬆症に対するMN-10-Tの第III相骨折試験
12
Nakamura T. et al.:J Clin Endocrinol Metab., 97(9), 3097(2012)
13
社内資料:骨折の危険性の高い原発性骨粗鬆症に対するMN-10-Tの第III相骨量試験
14
Isogai Y. et al.:J Bone Miner Res., 11(10), 1384(1996)
15
社内資料:卵巣摘除ラットにおける骨形成促進作用
16
社内資料:卵巣摘除カニクイザルを用いた18ヵ月間反復投与試験
17
Takao-Kawabata R. et al.:Calcif Tissue Int., 97(2), 156(2015)
18
Sugie-Oya A. et al.:J Bone Miner Metab., 34(3), 303(2016)
「主要文献」に記載の社内資料につきましても下記にご請求ください。
旭化成ファーマ株式会社 医薬情報部くすり相談窓口
*〒100-0006 東京都千代田区有楽町一丁目1番2号
フリーダイヤル 0120-114-936(9:00〜17:45/土日祝、休業日を除く)