1
倉智敬一ほか.産科と婦人科.1983;50(2):130-137.
2
社内資料:HMG注射用75IU「フェリング」の生物学的同等性試験
3
社内資料:HMG注射用150IU「フェリング」の生物学的同等性試験
4
高木繁夫.産科と婦人科.1975;42(4):114-117.
ヒト下垂体性性腺刺激ホルモン剤
1瓶 1305円
有効成分 | 日局 ヒト下垂体性性腺刺激ホルモン (閉経後婦人の尿由来) |
|---|---|
添加剤 | 乳糖水和物(賦形剤) 適量 ポリソルベート20(溶解補助剤) 0.1mg 水酸化ナトリウム(pH調節剤) 適量 希塩酸(pH調節剤) 適量 |
| 含量 | 卵胞刺激ホルモン(FSH)として75単位 |
| 添付溶解液 | 日局 生理食塩液 1mL |
有効成分 | 日局 ヒト下垂体性性腺刺激ホルモン (閉経後婦人の尿由来) |
|---|---|
添加剤 | 乳糖水和物(賦形剤) 適量 ポリソルベート20(溶解補助剤) 0.1mg 水酸化ナトリウム(pH調節剤) 適量 希塩酸(pH調節剤) 適量 |
| 含量 | 卵胞刺激ホルモン(FSH)として150単位 |
| 添付溶解液 | 日局 生理食塩液 2mL |
| 性状 | 本剤は、白色〜帯黄白色の凍結乾燥製剤である。 |
|---|---|
| 溶状 | 添付溶解液に溶かした溶液(75単位/mL)のpH及び浸透圧比は次のとおりである。 pH 6.0〜8.0 浸透圧比 1.1〜1.3(生理食塩液に対する比) |
| 性状 | 本剤は、白色〜帯黄白色の凍結乾燥製剤である。 |
|---|---|
| 溶状 | 添付溶解液に溶かした溶液(75単位/mL)のpH及び浸透圧比は次のとおりである。 pH 6.0〜8.0 浸透圧比 1.1〜1.3(生理食塩液に対する比) |
| 薬剤名等 | 臨床症状・措置方法 | 機序・危険因子 |
|---|---|---|
排卵誘発及び卵胞の最終成熟に使用する薬剤 ヒト絨毛性性腺刺激ホルモン製剤等 | 卵巣過剰刺激症候群があらわれることがある。 | 卵巣への過剰刺激に伴う過剰なエストロゲンにより、血管透過性が亢進される。 |
頻度不明 | |
|---|---|
過敏症 | 発赤、発疹、ほてり |
投与部位 | 疼痛 |
その他 | 悪心、頻尿、しびれ感、頭痛、浮腫、尿量増加 |
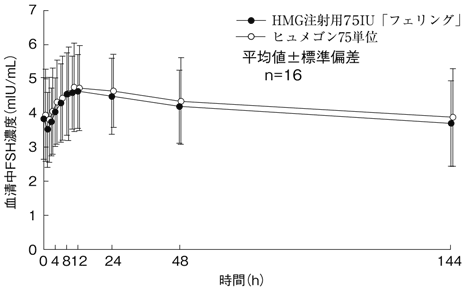
判定パラメータ | 参考パラメータ | ||
AUC0-144h (mIU・h/mL) | Cmax (mIU/mL) | MRT0-144h (h) | Tmax (h) |
588.56±156.12 | 4.87±1.11 | 67.72±2.86 | 13.40±10.70 |
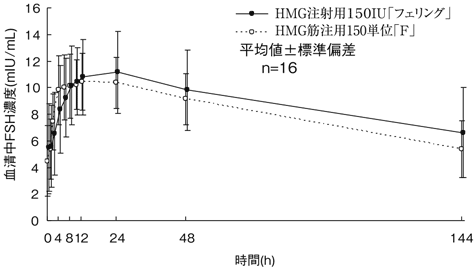
判定パラメータ | 参考パラメータ | ||
AUC0-144h (mIU・h/mL) | Cmax (mIU/mL) | MRT0-144h (h) | Tmax (h) |
1277.73±441.22 | 11.42±3.09 | 61.7±4.4 | 19.0±6.8 |