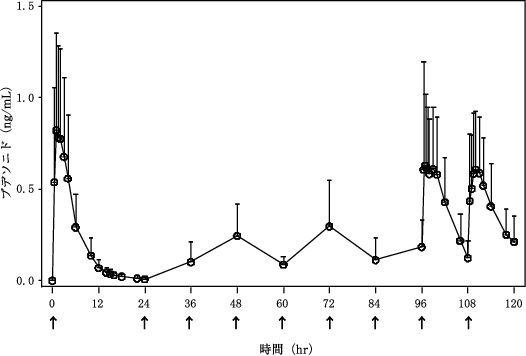
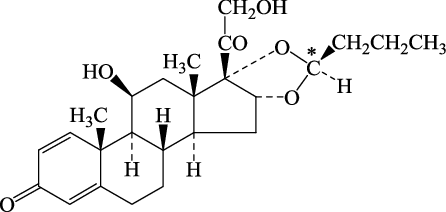
1
迚野 勲 他:基礎と臨床, 1985;19:153-178
2
Kihlström I., et al.:Arzneimittelforschung, 1987;37:43-46
3
Fält A., et al.:J Allergy Clin Immunol, 2007;120:798-802
4
Jönsson G., et al.:Drug Metab Dispos, 1995;23:137-142
5
Lu C., et al.:Drug Metab Dispos, 2008;36:1255-1260
6
EAファーマ株式会社:社内資料(第Ⅰ相試験結果)(2017年9月27日承認、申請資料概要2.7.6.1)
7
Ryrfeldt Å., et al.:Eur J Respir Dis, 1982;122(Suppl):86-95
8
Seidegård J.:Clin Pharmacol Ther, 2000:68;13-17
9
Raaska K., et al.:Clin Pharmacol Ther, 2002;72:362-369
10
EAファーマ株式会社:社内資料(第Ⅲ相試験結果)(2017年9月27日承認、申請資料概要2.7.6.6)
11
Brunner M., et al.:Aliment Pharmacol Ther, 2005;22:463-470
12
Hochhaus G., et al.:In:Möllmann HW, May B(eds). Glucocorticoid Therapy in Chronic Inflammatory Bowel Disease-From Basic Principles to Rational Therapy, 1993;61-79
13
Zareie M., et al.:J Pharmacol Exp Ther, 1999;289:1245-1249
14
Fabia R., et al.:Aliment Pharmacol Ther, 1994;8:433-441
15
広井 純 他:日薬理誌, 1985;86:219-231